点击关注↑药研技术汇
点击关注↑药研技术汇
欢迎点赞和转发哦~
《课程推荐》
3月26日注册申报受理最新资料撰写M4模板【特惠2人1500元/人】北京市-名额有限,先到先得!
1.目的:
本规程定义了 GMP 计算机及自动化系统关于数据备份恢复的基本通用规程。规程涉及了数据的产生,存储和归档,采用独立的物理介质备份机制以避免系统因意外事故,网络中断,病毒恶意攻击,系统或软件参数修改等造成重要数据的丢失。
2.范围:
本操作规程适用于公司所有GMP计算机和自动化系统的电子数据管理,此类系统用于或为GMP法规环境提供支持。
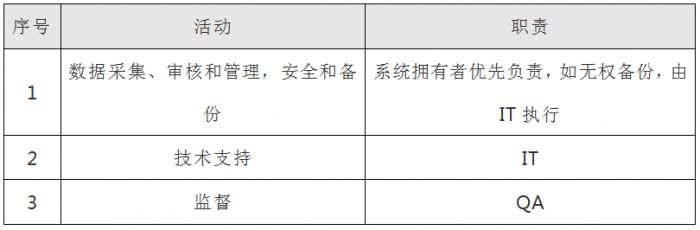
3.职责
4.术语和定义
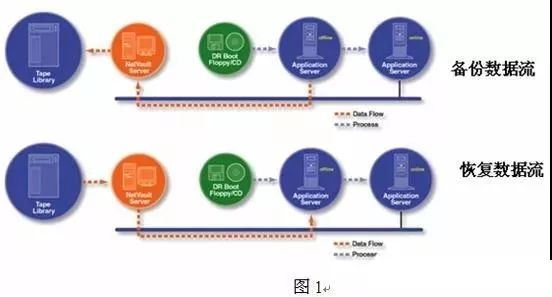
4.1备份/恢复:备份是指复制记录、数据和软件的过程,用以预防原始记录、数据和软件的完整性和可用性的损失。恢复是指随后在需要时还原己备份的记录、数据或软件
4.2存档:存档是指通过将记录和数据转移到另外的位置或系统,以使其不可在当前工作中使用的过程,这通常能使这些记录和数据不再变动。有时还需要同时保存支持这些记录和数据的应用程序。存档记录应该可以很容易地获取,以用于商业目的或监管目的。
5.程序
5.1应将计算机系统的数据和软件进行周期性的备份,并做好记录(见附件1)。所有备份介质存放在档案室,按照《档案管理规范(Q/CDGK3.18)》的相关要求进行管理,一律不准外借,不准流出公司,任何人员不得擅自取用,更不得私自再备份。归档的备份介质取用,需经质量负责人批准,并填写《档案借阅审批表》。借用人员使用完介质后,应立即归还,由档案管理员检查,确认介质完好。
5.2独立的数据文件,数据每次以独立的数据文件产生,可以由应用程序直接从磁盘分别调用,如HPLC Chemstation 产生的数据文件,这样文件的备份可以只备份新增的文件。
5.3文件型数据库的应用程序通常不提供备份功能,备份时需要从磁盘上直接复制数据库,比如Access 数据库。由于所有数据存贮与一个数据库内,需要对数据库全部复制。
5.4关系型数据库是同时存放数据及其关系的数据库,这些数据库通常由应用程序提供备份功能或自动备份功能,对于这类数据库应采用完全备份的方式进行备份,备份后的文件复制在备份磁盘上。
5. 5备份周期通常可以设定为一个月,如果程序自动备份,异地备份的周期可为一年。
5.6可通过备份前后文件或文件夹的大小、文件数量来核查被备份的文件或文件夹的完整性,并进行登记,表格见附件1。
5.7每半年应对之前的备份介质进行一次检查,应随机抽取至少一份备份介质,在该备份介质上调用至少1个备份数据,并打印相关报告,作为附件并登记,检查表格见附件2.
5.8存放备份数据的介质必须具有明确的标识;标识必须使用统一的命名规范,注明介质编号、介质的启用日期、保留期限和系统管理员等重要信息。
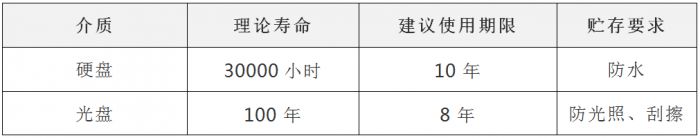
5.9本公司数据备份的介质通常选择光盘或移动硬盘,其使用和储存条件为:
5.10如因系统或设备升级等原因,原记录和数据不再发生变化,可以将记录和数据转移到另外的位置或系统,同时保存支持这些记录和数据的应用程序,进行存档备份处理。存档备份的数据应该可以很容易地获取,以用于商业目的或监管目的。
备份文件的保存时间至少为产品效期后一年,出口的原料药保存时间为该批产品销售后三年。过期或不能使用的备份媒介应通过受控的方式进行销毁或处置,由数据使用部门和质量管理人员现场见证销毁或处置过程,并提供有签名的证明文件。
5.11系统出现故障或损坏时,可以由系统管理员调取备份的电子数据进行恢复。未及时进行备份的数据,经质量监督管理部门调查分析后,决定是否重新检验。包括系统故障和数据错误在内的所有事故都应当被记录和评估,重大的事故应当进行彻底调查,识别其根本原因,并采取相应的纠正措施和预防措施。
5.12在备份、归档和恢复过程中,出现的错误应详细记录在备份日志中,必要时报告偏差,并进行调查处理。
6.附件
附件1: 电子数据备份记录
附件2: 电子数据备份检查记录
附件1 电子数据备份记录

附件2 电子数据备份检查记录
免责声明:文章版权归原作者所有。如涉及作品内容、版权和其它问题,请跟我们联系删除!文章内容为作者个人观点,并不代表本公众号赞同或支持其观点。本公众号拥有对此声明的最终解释权。
2021制药企业培训通知:
地点 时间 点开课题链接阅读全文 南
京2021年3月19-21日 2021《药品上市后变更管理办法》全面解析及企业贯彻实施专题培训班 上
海2021年3月19-21日 2021 cGMP新厂建设项目管理专题培训班 南
京2021年3月19-21日 蛋白质、多肽类药物开发,申报、生产工艺及检测技术研讨会 上
海2021年3月25-26日 药品研发分析和QC实验室合规管理的优化与创新专题研修班 南
京2021年3月25-28日 2021第六届精细化工废水、废气、危废处理新技术、新成果、新设备应用发布推广年会暨三废项目对接研讨会 北
京2021年3月26-28日 注册申报受理最新要求及合规的资料撰写M4模板【特惠2人1500元/人】 南
京2021年3月26-28日 微生物发酵过程工艺优化与中试放大关键技术与难点解析经验分享培训会 成都 2021年3月26-28日 2021研制和生产现场检查要点及实例剖析培训班 南
京2021年3月26-28日 【南京】化工、医药工艺开发、优化、质量研究及中试放大专题研修班 南
京2021年3月29-31日 药品技术转移、工艺验证和清洁验证最新要求与合规操作【李永康】 上
海2021年4月9-11日 2021药物非临床安全评价关键技术专题培训班 上
海2021年4月16-18日 药品上市后变更管理与工艺验证和持续工艺确认技术高级研修班 现在报名参加培训的学员将获得价值499元药成材线上培训VIP年度会员,200节直播课程免费学习,包括所有专栏、直播及单个课程;同时能够实时在线咨询,与专家互动!
课程咨询扫描二维码了解详情
【提供制药企业及相关单位内训服务】
添加微信15910678046免费获取专业书籍,
课件PPT,有机会获取免费名额参会!
请注明:公司+姓名+职位+电话

关注药研技术汇每天都有药届新闻和课件与大家一起分享!



 个人中心
个人中心
 我是园区
我是园区