
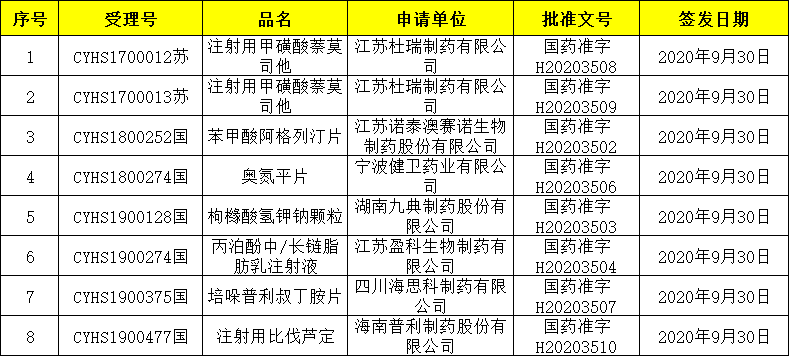
10月9日,国家药品监督管理局发布一批药品批准证明文件,8个药品通过一致性评价,其中江苏杜瑞制药的两批注射用甲磺酸萘莫司他、江苏盈科生物制药的丙泊酚中/长链脂肪乳注射液、四川海思科制药的培哚普利叔丁胺片为首家过评。
江苏杜瑞制药:注射用甲磺酸萘莫司他
甲磺酸萘莫司他为作用强且广谱的丝氨酸蛋白酶抑制剂,本品由日本Tobacco公司研发,适应症为弥散性血管内凝血(DIC)的预防与治疗、胰腺炎急性症状的改善及血液体外循环时的抗凝。目前,日本已经将萘莫司他纳入新冠肺炎候选治疗药物。
该药原研目前并未在中国申报。江苏杜瑞制药于2017年6月按3类在中国提交首家上市申请,此次获批上市则成为国内首仿。
江苏盈科生物制药:丙泊酚中/长链脂肪乳注射液
丙泊酚中/长链脂肪乳注射液是一种短效、全身用麻醉剂,被广泛应用于围手术期的麻醉诱导、麻醉维持,以及ICU病房的镇静。
江苏盈科生物制药于2019年4月按4类提交该药上市申请,此次获批成为该品种首家过评。
四川海思科制药:培哚普利叔丁胺片
培哚普利由施维雅 Servier 开发,是第三代血管紧张素转换酶(ACE)抑制剂,也是一线、长效的降压药物之一,用于高血压与充血性心力衰竭。该产品为非巯基长效ACEI抑制剂,与其他ACEI抑制剂相比,起效慢但对脑中ACEI的抑制作用最强,耐受性好,不引起高血糖,对血脂亦无不良影响,安全性好。
目前国内培哚普利叔丁胺仅施维雅的产品作为原研地产化的品种视同通过一致性评价。获批上市的仿制药仅一家,来自上药东英,但其上市时间较早,为 2009 年,尚未通过一致性评价。2019 年 12 月 25 日上药东英提交补充申请获 CDE 受理,目前尚在审评审批中。海思科本次新注册分类获批,意味着其成为该药国内首家过评。
◆来源 | 国家药品监督管理局
◆编辑 | 亦一

以共享招标信息,提供优质服务企业为目标,是为各药品生产企业、经营企业、政府机构、研究机构、业内人士提供专业的招标资讯、服务的专业网站,想了解更多服务详情可通过关注我们官方微信公众号、公司官网或致电等方式联系我们。





 个人中心
个人中心
 我是园区
我是园区




