速递!原启生物完成超1.2亿美元B轮融资
收藏
关键词:
生物融资B轮
资讯来源:医药观澜 + 订阅账号
发布时间:
2022-08-01
▎药明康德内容团队报道
8月1日,原启生物宣布完成总金额超过1.2亿美元的B轮融资,本轮融资由启明创投和泉创资本共同领投,新投资方上海科创基金、健壹资本(原国药资本)、苏州基金、博荃资本及若干国际投资基金跟投,原股东建发新兴投资继续增持。根据原启生物新闻稿,本轮融资资金将主要用于推进公司十余条经过充分概念验证(POC)的肿瘤细胞治疗产品管线的开发和商业化进程,继续完善公司自主创新技术平台的建设,以及未来商业化生产基地的规划与建设。

原启生物成立于2015年,致力于开发肿瘤细胞免疫治疗产品。在产品研发进展方面,该公司首个自主开发的靶向GPC3治疗晚期肝癌的CAR-T产品Ori-C101的临床试验申请已获得中国国家药监局药品审评中心(CDE)受理。在过往的临床研究中,Ori-C101已经在GPC3阳性晚期肝癌患者中表现出良好的安全性和有效性。原启生物于2021美国癌症学会年会(ASCO)上公布的研究者发起的1期临床试验数据显示,该产品表现出44%的客观缓解率(ORR),78%的疾病控制率(DCR),其中07号患者回输28天后MRI结果显示最大肿瘤直径从133mm减少至9mm,缩小超过93%。迄今临床随访数据显示,最长缓解已超过22个月,目前该研究仍在持续随访中。
此外,原启生物还开发了GPRC5D CAR-T产品OriCAR-017用于治疗复发/|难治多发性骨髓瘤(MM),该产品已在研究者发起的1期临床试验中展现出了较好的治疗潜力。研究人员曾以口头报告形式分别在2022年ASCO年会、2022年欧洲血液学协会(EHA)年会上公布了截止至2022年4月30日的临床结果。数据显示,包括5例既往BCMA CAR-T治疗失败的受试者在内的所有受试者,均获得100%的ORR和100%微小残留病灶(MRD)阴性率,持续无进展,无需任何额外抗肿瘤治疗以及良好的安全性。目前,原启生物正在加快推进该药在中美两地的注册及临床开发。
在产品合作方面,原启生物于2019年授权许可给德琪医药的一款PD-L/4-1BB的双特异性抗体OriBS-001(德琪医药研发代号为ATG101)。继获得美国FDA和澳大利亚TGA临床试验批件后,该药也在今年3月份获得了CDE的临床试验默示许可。
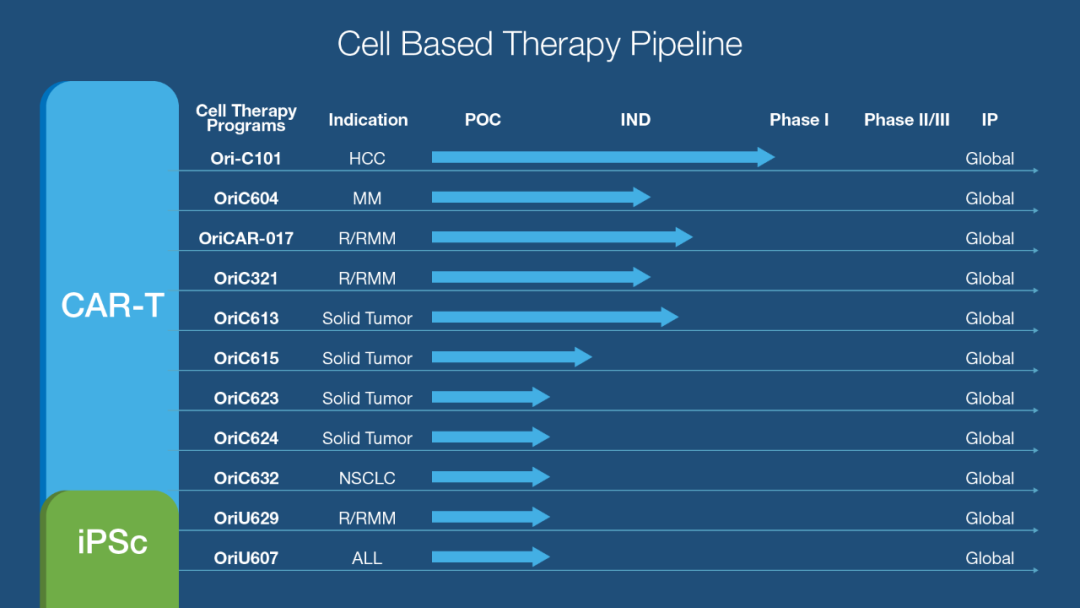
▲原启生物研发管线(图片来源:原启生物提供)
原启生物董事长兼CEO杨焕凤博士
表示:“在遭受业界普遍认为的‘资本寒冬’和疫情双重挑战下,我们顺利完成了B轮超过1亿美元的融资。非常感谢本轮投资方初心不改,给予原启生物和我们团队的高度认可和支持。我相信,原启生物将在未来的三年时间里,在原研创新和临床价值上达成更多的里程碑。在当今国内开放包容、富有活力的创新医药生态环境中,我们将持续努力,早日成长为具有广阔视野、融入全球创新体系的生物制药企业。”
启明创投主管合伙人胡旭波
表示:“作为原启生物首轮投资方及每轮投资的参与者,我们深度参与和支持原启生物基于临床价值的创新研发。中国的创新研究和临床能力一直在发展,并在某些领域有潜力达到国际领先水平。我们从包括原启生物在内的很多创业公司的发展路径上,也看到了中国创新企业成为全球创新重要组成部分的趋势。我们对原启生物充满信心和期望,并将持续支持公司的发展。”
泉创资本执行董事杨颖莹
表示:“细胞治疗一直是泉创的重点关注赛道,尤其在实体瘤领域,我们认为目前仍然存在很大的未满足需求。我们十分看好原启生物的技术平台储备和研发管线潜力。与此同时,我们也会和公司优秀的管理团队一起,帮助优化和推进管线的布局和进展,助力原启生物成为细胞治疗领域的未来领导者。”
本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发至朋友圈。转发授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。







 个人中心
个人中心
 我是园区
我是园区




