邹贻龙/Stuart Schreiber团队合作报导快速鉴别组织或细胞对铁死亡敏感性的成像方法
收藏
关键词:
合作细胞
资讯来源:BioArt + 订阅账号
发布时间:
2021-11-28

铁死亡是一种由细胞膜内多不饱和磷脂的异常过氧化引起的非凋亡性细胞死亡程序。近期研究发现细胞发生铁死亡参与人体多种疾病与组织损伤过程,包括缺血/再灌注诱导的肝、肾、心、脑损伤等急性器官损伤和神经退行性病变等。另一方面,有研究表明,多种恶性肿瘤细胞对铁死亡高度敏感,包括肾癌和卵巢癌的透明细胞癌、胰腺癌、弥漫性大B细胞淋巴瘤、肝癌、结直肠癌和已获得耐药性的癌细胞。因此,诱导人类肿瘤细胞的多不饱和脂质过氧化和铁死亡是一种有前景的癌症治疗策略。
靶向铁死亡通路的咪唑酮及重组半胱氨酸酶等药物已表现出肿瘤抑制作用,或直接调节多不饱和脂肪酸水平也表现出良好的肿瘤抑制疗效。然而,目前仍然缺乏经过临床验证的可以指示体内铁死亡敏感性的生物标志物,也没有特定的基因型及原发肿瘤谱系可以预测铁死亡的反应性。快速鉴别铁死亡诱导剂对癌症患者是否有潜在治疗效果仍然是开发铁死亡靶向药物的主要挑战。因此,亟需一种快速筛查和无创评估患者细胞组织对铁死亡敏感性的技术,实现铁死亡药物的个体化高效治疗。
针对上述问题,2021年11月22日,西湖大学邹贻龙团队在Cell Chemical Biology上以“Resource”的形式发表了文章
PALP: A rapid imaging technique for stratifying ferroptosis sensitivity in normal and tumor tissues in situ
,
开发了一种快速鉴别动物组织对铁死亡敏感性的方法
。该方法被命名为Photochemical Activation of Lipid Peroxidation
(
PALP
)
,即
激光诱导脂质过氧化技术
。PALP利用高功率脉冲激光,以光化学方式诱导生物膜上局部脂质过氧化
(lipid peroxidation)
,通过脂质过氧化传感器捕获并检测荧光强度。由于脂质过氧化是细胞发生铁死亡的主要驱动因素,细胞在PALP诱导下发生的脂质过氧化强度可以用于预测细胞对铁死亡诱导剂的敏感性。
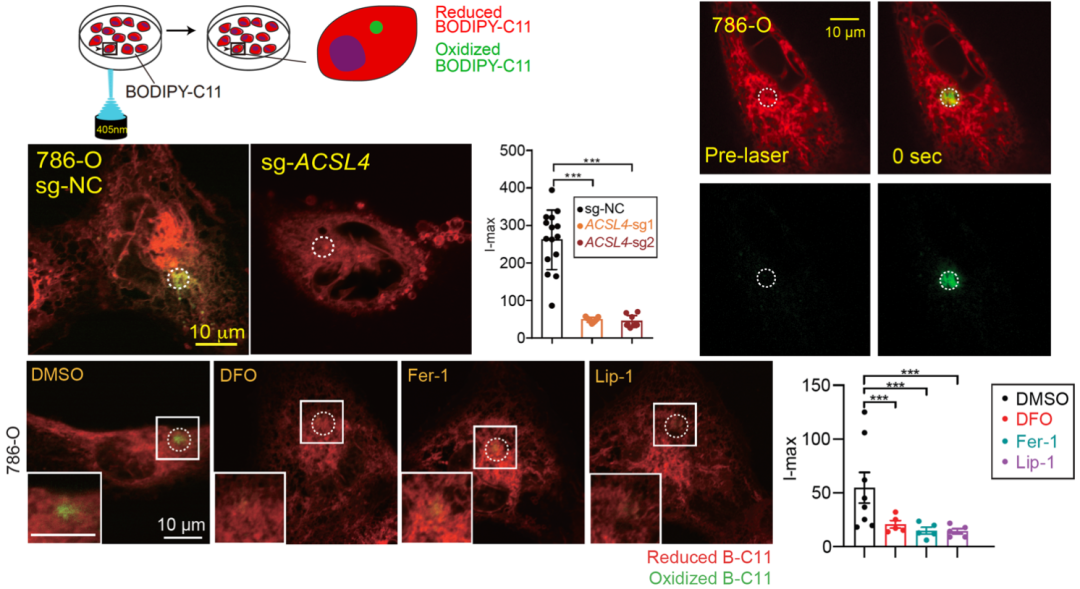
为了对PALP相关思路进行验证,该团队成员首先在多种培养中的细胞品系上施加高度聚焦的激光诱导,例如人源肾癌细胞、卵巢癌细胞、小鼠原代神经元及鼠源肾上皮细胞等
(图1)
。荧光显微镜分析表明PALP在所有细胞中都引发了不同强度的脂质过氧化。而采用铁离子螯合剂和自由基捕获剂都会使激光刺激后信号强度减弱,说明激光诱导的信号与脂质过氧化相关。通过敲除酰基辅酶A合成酶ACSL4,阻断细胞多不饱和脂质的合成,可以使得激光信号减弱。并且,在培养基中添加多不饱和游离脂肪酸后,激光信号增强,说明该方法诱导的信号与多不饱和脂质的含量呈正相关。
图1. PALP即激光诱导脂质过氧化技术的工作原理和在细胞水平的验证。
为了避免常规激光对组织的穿透损伤,该团队通过结合近红外双光子显微镜
(Two-photon microscope)
光源与PALP, 提出了改良版的二代PALP
(PALPv2)
技术。初步实验分析表明,双光子光源穿透力弱,对组织损伤小,且只诱导焦平面脂质过氧化,有利于开展细胞特定膜层面的脂质研究。
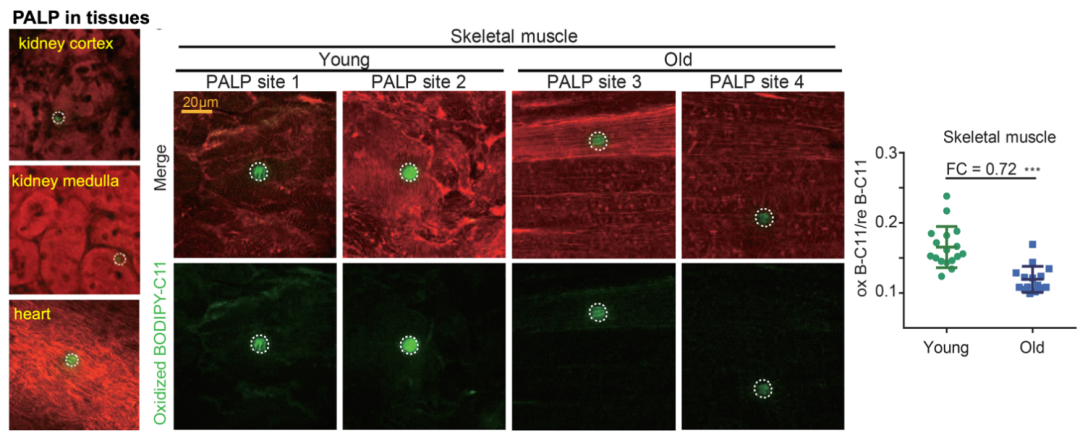
为扩充PALP方法的应用面,研究者发现强脉冲的激光光源也能诱导组织切片发生局部过氧化,并已经在小鼠肾脏、心脏、骨骼肌、肿瘤中得以验证
(图2)
。
图2. PALP用于检测组织中的多不饱和脂质水平。
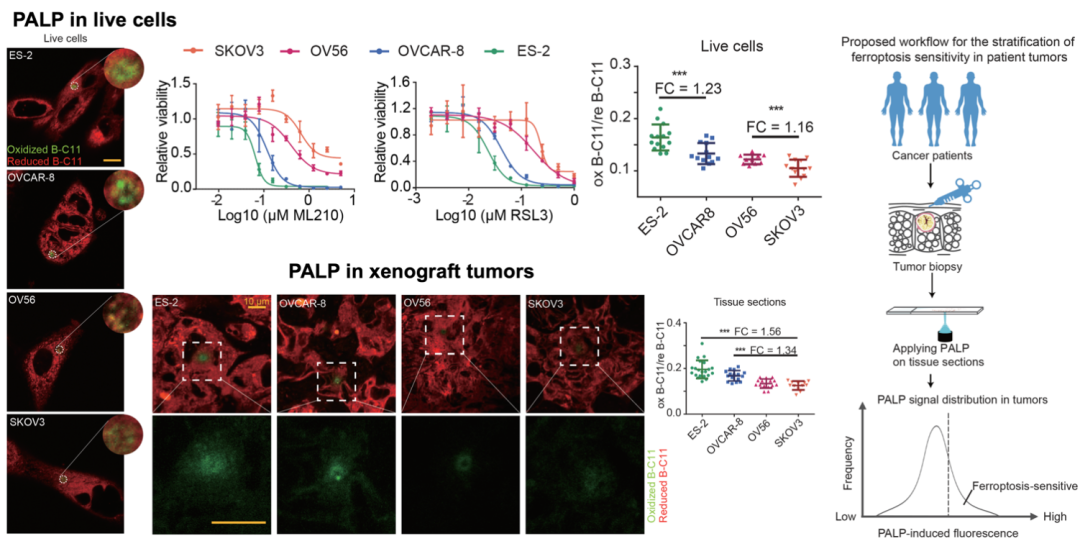
多不饱和脂质的含量是影响细胞发生铁死亡最重要的因素之一。为了分析PALP是否可以用于组织或细胞对铁死亡敏感性的前瞻性预测,作者选择了四种对铁死亡具有不同敏感性的卵巢癌细胞系,分别将其移植到免疫缺陷小鼠皮下,不同肿瘤组织间激光诱导信号强度的差异与四种细胞对铁死亡诱导剂的敏感性差异相同,且与切片上多不饱和脂质水平相关
(图3)
。因此,本研究可以在高时空分辨率下测定局部多不饱和脂质的含量,反映生物组织对铁死亡的敏感性,并预测肿瘤组织对铁死亡诱导剂的响应能力。该方法成本低廉、操作便捷、对组织无损,为开发铁死亡靶向药物提供新型方案。
图3. PALP用于鉴别组织和细胞对于铁死亡诱导剂的敏感性差异。
本研究成果可以快速预测和无创评估患者肿瘤细胞或组织对铁死亡的敏感性,从而快速鉴别铁死亡诱导剂对癌症患者是否具有潜在治疗效果,有利于推进靶向铁死亡通路的抗癌药物开发及应用。
另外,本成果可辅助研究多不饱和脂类生物学功能和脂质过氧化等问题,为开发针对肿瘤铁死亡的临床治疗方案提供有力支撑。
本研究的第一作者包括西湖大学博士研究生王凤翔,Broad Institute的科研助理Emily Graham,以及邹贻龙实验室博士后Nathchar Naowarojna和石振楠。通讯作者为西湖大学PI邹贻龙和Broad Institute的Stuart Schreiber教授。本研究的合作者包括西湖生物信息学与基因组学核心实验室王曦老师,西湖大学生命科学学院贾洁敏老师和清华大学生命科学学院俞立老师实验室黄雨薇博士后等。
备注:该研究的主要通讯作者邹贻龙博士现为西湖大学生命科学学院特聘研究员,并兼任西湖多维动态代谢组学核心实验室 (Meta4D) 主任。西湖Meta4D实验室依托于浙江西湖实验室智能生物医学技术中心,旨在建立全面先进的代谢研究平台,开发新型代谢分析技术,详细解析重大疾病包括肿瘤与神经退行性疾病发生发展过程中的代谢调控,并有针对性的展开药物研发。实验室团队高度专注于代谢前沿研究;队伍专业高效,气氛活跃,年轻有朝气,有着良好的职业发展空间。该实验室目前有多个助理研究员,博士后,科研助理岗位开放招聘。
详情请查阅: https://meta4d.westlake.edu.cn/ 以及 https://yilongzou-lab.com。期待同样对科研充满热情的学者加盟!
https://jinshuju.net/f/ZqXwZt
或扫描二维码
投递简历
https://doi.org/10.1016/j.chembiol.2021.11.001
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 药选址
药选址





