
医疗器械质量法规比较枯燥,普通人学习常常不知如何入门且很难坚持。我们为此开设了医咖网上课堂和在线打卡学习营,帮助大家一起学习,同学同乐同成长!
有朋友们,医咖网上课堂学习有何优势,我们简单列几条供大家参考:
所有课程配套课件及音频,课件和讲解随动播放;
播放速度可调,从0.8-2倍,听不懂可慢放,快放则可节省时间;
听到一半有事走开,课程可随时暂停,回来后记忆位置可继续播放;
课程内容深入浅出,语言通俗易懂,保证能听懂;
一个人学太孤独,加入打卡学习群,有浓厚的学习氛围,还可讨论;
课代表每天督促按时打卡,坚持完成打卡可获得培训证书;
使用千聊APP,听课不影响使用微信,适合上下班路上或开车时听
还有很多亮点等你来体验!
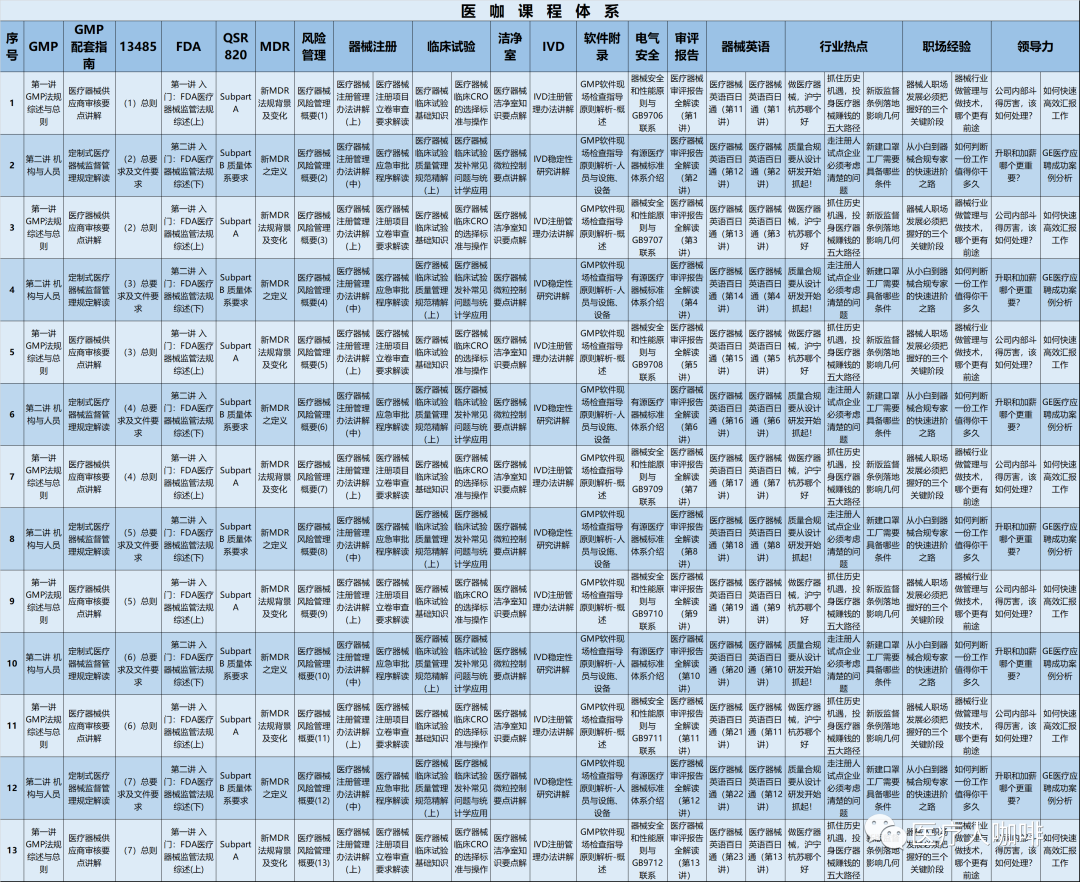
医咖第二十六期学习营课表

欢迎加入医咖第26期学习营!
今年的学习营,我们全新改版!韩老师对每位参加学习营的朋友提出新要求:
学习营开营时每位同学需要自我介绍,承诺每天完成学习任务并在群里发送学习图片作为打卡证据“;
每天早上韩老师会将今日课程链接发入学习营,并简单讲解本节课程内容;
每晚7点开始,大家可以将学习图片发入学习营,如有问题可顺带提问,大家可讨论交流
10天的学习营会组织3次打卡抽查,未按时打卡者会被公示提醒,如第二次抽查依旧未打卡将会被移除学习群并无法获得学习证书。
报名时间: 2月25日至3月2日
开课时间: 3月2日至3月11日(共10天)
报名资格: 医咖网课畅听卡会员免费参加,非会员请联系韩老师入会参加
报名方式: 通过韩老师微信报名
学习营分类: 分设医疗器械GMP学习营(1营)、无菌知识学习营(2营)和器械英语学习营(3营),每天学习及打卡时间大约需要40分钟,我们希望大家能够专注每天的学习内容,因此每人限定报名一个学习营!
学习方式: 每日一节课,课程已录入医咖网上课堂,请大家按课表自主安排学习时间(建议在每天晚饭后),并在每晚6-11点之间将学习截图、笔记或思维导图分享到打卡学习群中,作为学习证据。学习营课代表会统计每日打卡人数,如超过三次不打卡将被移出学习群。
学习成果: 完成所有课程打卡的同学都将会获得培训证书。此外,每期将评选出三名认真学习的同学(根据学员分享的心得),可获赠医疗人咖啡纪念品一个(无需任何费用)。
与大家共勉: 医疗人咖啡不但提供课程与资料,更会推动每个会员自主学习,为大家的能力提升和职场进阶带来帮助和价值!我们希望大家深刻认识到学习是为了自己,既然要参加学习营就应该认真学习、主动学习和大家一起吃学习的苦,坚持完成学习计划不仅能提升专业能力,更能提升自信心!
需要报名的会员朋友请通过微信向韩老师告知选择参加哪个营!
未入会的朋友请先告知韩老师需要入会再告知参加哪个营!

Q:如何加入医咖网上课堂会员?
A:添加韩老师微信获取200元优惠券后购买会员(会员费原价599,抵扣后实际只需支付399元)。
韩老师:医疗人咖啡联合创始人,全国质量奖评审员,医疗器械战略规划及合规专家。辅导监管机构和知名企业上百场。对医疗器械的注册法规及质量管理有深厚的理论功底和丰富的实战经验。
Q:网上课堂的课件能提供吗?
Q:如何使用医咖网上课堂?
A:微信端可进(二维码如下),可将此链接收藏在微信里。也可下载“千聊”APP,搜索直播间名称“医咖网上课堂”。
医咖已成功举办25期学习营。总计参与学员超过15000人次。学员们每天坚持40-60分钟时间系统学习医疗器械质量法规,并在打卡群里分享心得。参与学习的朋友们纷纷表示坚持不易但收获颇丰,很多朋友的高质量分享(如学习笔记、思维导图)都成为大家深化学习的优秀素材!

已上线的课程较多,医咖为大家梳理出课程体系帮助理解学习
点击后可查看清晰大图
第一讲GMP法规综述与总则
第二讲 机构与人员
第三讲 厂房、设施与设备
第四讲 文件管理
第五讲 设计开发
第六讲 采购
第七讲 生产管理
第八讲 质量管理及销售
第九讲 不合格品控制、不良事件监测及法规发展方向
医疗器械不良事件监测及再评价解读(上下)
医疗器械供应商审核要点讲解
定制式医疗器械监督管理规定解读
器械质量控制与成品放行要点解析
器械冷链运输贮存要点解析
器械企业管理者代表要点讲解
中国医疗器械飞检形势分析和应对策略
CAPA纠正预防措施的正确做法,与你想的不一样
医疗器械质量抽查检验管理办法讲解
医疗器械唯一标识系统试点解析
医疗器械留样管理要点解读
最新医疗器械注册人开展不良事件监测工作指南讲解
(1)总则
(2)总要求及文件要求
(3)管理职责
(4)资源管理
(5)产品实现
(6)测量、分析与改进
ISO13485和GMP差异分析
医疗器械审核到底怎么查造假?
器械合规难点解疑(6节)
第一讲 入门:FDA医疗器械监管法规综述(上)
第二讲 入门:FDA医疗器械监管法规综述(下)
第三讲 学习:QSR820十大难点要点解读(上)
第四讲 学习:QSR820十大难点要点解读(下)
第五讲 洞悉:FDA在华审计的特点(上)
第六讲 洞悉:FDA在华审计的特点(下)
第七讲 实用:如何应对FDA检查 (上)
第八讲 实用:如何应对FDA检查(下)
FDA网站到底怎么检索利用?
NMPA境外审核与美国FDA在华审核深度透视
SubpartA
Subpart B 质量体系要求
Subpart C 设计控制
Subpart H&I&J 验收活动/不合格品控制/CAPA
Subpart K&L标签和包装/搬运储存发运和安装
Subpart M&N&O记录/服务/统计技术
DHR\MDF\DMR\DHF\MDR\DMF的含义阐释
FDA审核员培训指南(QSIT)讲解
新MDR法规背景及变化
定义
协调标准和通用规范
经济运营商的责任义务及器械销售
法规符合性人员职责
特殊器械或附件的要求
器械的标识及数据库
器械及其经济运营商的登记和电子系统
安全和临床性能总结
医疗器械分类
欧盟医疗器械符合性评估流程及公告机构参与
医械风险管理概要(1)
医疗器械风险管理概要(2)
医疗器械风险管理概要(3)
医疗器械风险管理概要(4)
医疗器械风险管理概要(5)
医疗器械风险管理概要(6)
医疗器械风险管理概要(7)
医疗器械风险管理概要(8)
2019版ISO14971与2007版的区别
GB2828-2012计数抽样检验浅析
医疗器械注册管理办法讲解(上)
医疗器械注册管理办法讲解(中)
医疗器械注册管理办法讲解(下)
医疗器械注册单元划分解析
注册检验法规和常见问题讲解
医疗器械注册指定检验解读
医疗器械产品技术要求讲解
医疗器械说明书和标签管理规定解读
新版医疗器械分类目录解析(上)
新版医疗器械分类目录解析(下)
医疗器械注册项目立卷审查要求解读
医疗器械应急审批程序解读
医疗器械注册变更难点解析
创新医疗器械特别审查程序解析
医疗器械安全和性能基本原则要点解析
医疗器械标准管理办法解读
怎样顺利通过注册体考
医疗器械注册质量管理体系核查指南精解
医疗器械附条件批准上市指导原则解析
医疗器械临床试验基础知识
医疗器械临床试验质量管理规范精解(上)
医疗器械临床试验质量管理规范精解(下)
医疗器械临床试验参与方及职责讲解
医疗器械临床试验操作流程精解
医疗器械临床试验现场核查精解
医疗器械经营管理规范讲解
网络医疗器械经营监督管理办法解读
医疗器械广告审查办法讲解
体外诊断试剂临床试验方案设计与常见问题
医疗器械临床试验遗传办备案精解
医疗器械洁净室知识要点解
医疗器械微粒控制要点讲解
洁净室工艺用水知识要点精解
器械清洗过程确认要点讲解
医疗器械灭菌方法要点解析
洁净室工艺用气知识要点精解
剖析验证与确认区别到底在哪?
无菌包装封口过程确认要点讲解
GHTF过程指南要点讲解
IVD注册管理办法讲解
IVD稳定性研究讲解
IVD仪器电气安全讲解
IVD设备GB 4793.1/IEC 61010体系/术语介绍
IVD设备随机文件和标签要求
IVD设备安全设计规范
IVD设备EMC要求
器械安全和性能原则与GB9706联系
有源医疗器械标准体系介绍
医疗电气设备电气要求
医疗电气设备机械要求
医疗电气设备超温及故障要求
医疗电气设备结构设计要求
医疗器械软件合规概要(1)
医疗器械软件合规概要(2)
医疗器械软件合规概要(3)
做医疗器械,沪宁杭苏哪个好
质量合规要从设计研发开始抓起!
医疗器械计量没有你想象的那么难
降薪裁员寒潮来袭,器械人如何应对?
医疗器械企业如何选址落户
投资人眼中器械发展前景
新版监督条例落地影响几何
新建口罩工厂需要具备哪些条件
新型肺炎检测试剂到底准不准
贸易形势对医疗产业影响解析
医疗器械注册人试点详解
长三角注册人制度跨区监管办法解读
FDA口罩注册路径解析
口罩出口欧美注册要点讲解
外资品牌如何通过注册人试点快速国产化
进口器械注册证转境内生产政策解读
医疗器械英语百日通(100节)
器械人职场发展必须把握好的三个关键阶段
从小白到器械合规专家的快速进阶之路
外企/民企和初创公司,不同的生存法则和成长之道
做注册与做体系,哪个更有前途?
医疗器械行业跳槽的门道
器械行业入职五年必须思考的问题
医疗器械大外企的职场心得分享
遇到外行的领导你该怎么办?
为什么领导一会喜欢你一会又不喜欢你
职场发展三要素:人际关系、学习机会和收入
如何快速高效汇报工作
GE医疗应聘成功案例分析
医疗器械质量法规面试常见问题分析
长远去看做器械到民企还是到外企好
医疗器械行业跳槽的门道 如何快速提升质量与法规领导力
不受老板待见应该怎么办
如何兑现你的质量合规能力
老板是怎么思考问题的?
相悦定律——怎么才能让别人认同你
怀才不遇如何破局?
职场里的杠精都去哪儿了?
职场发展读书答疑会(10节课)




 个人中心
个人中心
 我是园区
我是园区




