2023年1月,美国FDA受理了Intercept Pharmaceuticals新药奥贝胆酸(Ocaliva,OCA)的NDA申请,用于治疗 NASH肝纤维化,NASH赛道的里程碑式突破近在咫尺。
对于历经波折的Intercept与奥贝胆酸而言,这同样是个重要里程碑——奥贝胆酸将有望成为全球治疗NASH的首款新药,一旦获批,将在这个拥有上百亿美元市场的领域中占得先机。
治疗NASH,Intercept是目前唯一一家向FDA递交了NDA申请的企业,这让它犹如NASH赛道的风向标,获批与否都受到了业内的集中关注。虽然离开发NASH新药的成功最近,但Intercept的研发之路走得并不顺畅,也见证和反映了NASH领域新药研发的不少困境。

多位知名药企高管加持,成就FXR激动剂的代表
Intercept成立于2002年,致力于研究、开发和商业化治疗慢性肝病的新疗法。公司创始人Mark Pruzanski博士以自己在胆汁酸与FXR受体方面的研究成果为基石,在纽约的一间小公寓中成立了Intercept,如今已经将其经营成为了一家超过300人的生物制药上市企业。在2012年上市之前,Intercept完成了共计5.671亿美元的8轮融资,除去债务融资与上市后融资外,Intercept曾完成由Genextra领投的A轮和B轮融资,以及由奥博资本领投的C轮融资。
以Pruzanski博士的研究为核心,Intercept研发NASH新药的策略聚焦在靶向胆汁酸与FXR受体上。胆汁酸在脂肪代谢中起着重要作用,主要存在于肝脏与肠道中,FXR是一种在肝脏和肠道中表达的核受体,是胆汁酸、炎症、纤维化、葡萄糖与脂质代谢途径的关键调节剂,其中,对胆汁酸的调节被认为是FXR受体最重要的生理功能。
目前科学研究显示,肝脏内的胆汁酸水平过高,会导致损伤与炎症,进而发展为肝纤维化和肝硬化,而当胆汁酸与FXR结合时,FXR被激活,可以降低肝脏脂肪生成,并增强低密度脂蛋白在外周组织中的清除效果,因此,FXR被视为治疗NASH的重要靶标。
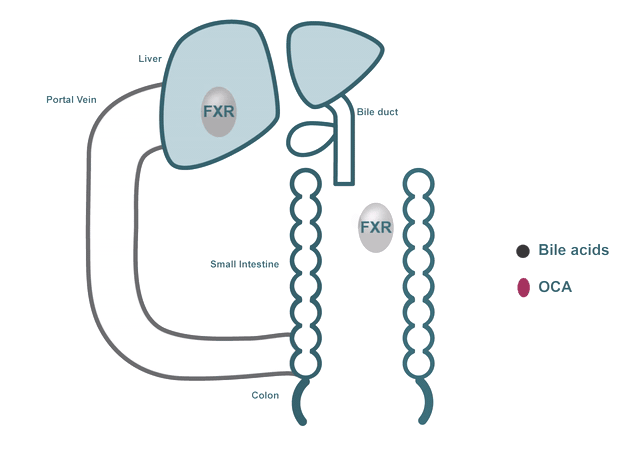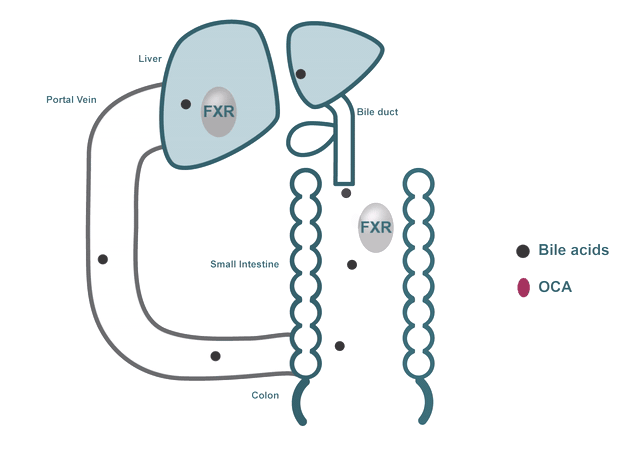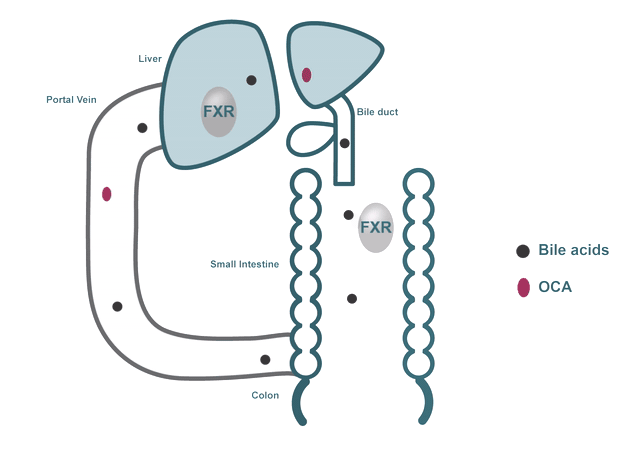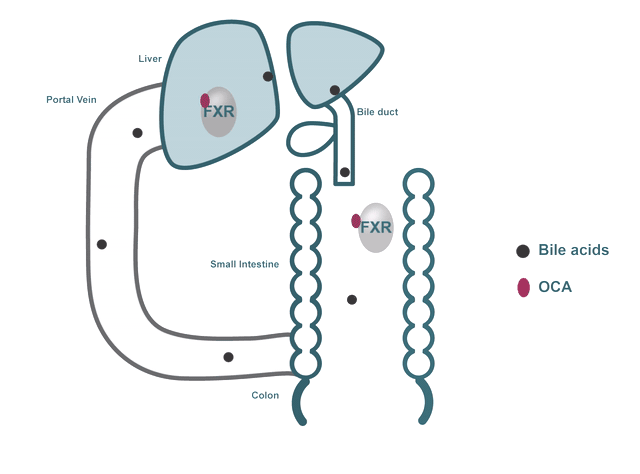
▲ 胆汁酸与FXR受体作用机制,图片来源:Intercept官网
基于这些科学理论,Intercept一直致力于FXR激动剂的研发,其核心产品奥贝胆酸就是在这一研发历程中诞生,并成为了全球FXR激动剂的代表。目前,奥贝胆酸仍然在引领FXR激动剂的研发,国内已有正大天晴、泽璟生物两家在进行奥贝胆酸仿制药的研发,歌礼制药、拓臻生物等药企也在对FXR激动剂进行创新,在国外,诺华、礼来、吉利德等大药厂对FXR激动剂的研发布局仍在继续。
奥贝胆酸之所以能够在NASH领域产生如此大的影响力,与Intercept的核心团队有着密不可分的关系。
创始人Mark Pruzanski在2021年卸任了Intercept的CEO一职后,由Jerome Durso接任。Jerome Durso拥有超过25年的业务运营经验,在2017年加入Intercept前,他职业生涯的大部分时间是在跨国药企赛诺菲度过,历任赛诺菲美国高级副总裁和首席商务官、赛诺菲全球糖尿病事业部首席商务官以及赛诺菲全球高级副总裁,这让Durso不仅拥有业务运营、市场营销等方面的经验,还对代谢疾病有着深入的了解。

▲ Jerome Durso,Intercept总裁兼CEO,图片来源:Intercept官网
Intercept的首席医疗官M. Michelle Berrey博士,在肝脏疾病领域拥有深厚功力。她曾在跨国药企GSK担任病毒感染疾病、临床药理学和药物发现部门的副总裁,负责肝炎病毒、肝纤维化以及HIV等药物的早期研发。离开GSK后,她加入Pharmasset 担任首席医疗官,在研发丙肝药物Sovaldi的过程中发挥了关键作用,期间,Pharmasset在2011年被吉利德收购,Sovaldi在2013年上市,第一年销售额就破百亿美元,成为了治疗丙肝的神药。Berrey博士的加入,不仅对Intercept目前管线的药物研发帮助巨大,还会为后续的管线布局奠定基础。

▲ M. Michelle Berrey,Intercept CMO,图片来源:Intercept官网
除了药物研发与商业化运营需要关注外,药物的后期工艺开发也意义重大。首席质量官Kathleen Munster曾在默克、BMS等知名MNC工作,承担质量以及供应链方面的重要职责,后加入CDMO巨头Catalent任副总裁,负责生物制剂、细胞与基因治疗的质量保证。这些经验让她能够在生物制剂、药物生产、产品质量控制等方面为Intercept保驾护航。

▲ Kathleen Munster,Intercept CQO,图片来源:Intercept官网
奥贝胆酸治疗PBC成功上市,NASH成为新挑战
目前,Intercept拥有一款成功上市的产品奥贝胆酸,以及3条在研管线,但整个公司的研发重心,仍然侧重在推进奥贝胆酸治疗NASH的临床进展上。
2016年对于Intercept来说,是个历史性的时间节点。这一年,美国FDA加速批准奥贝胆酸用于治疗原发性胆汁性肝硬化(PBC)患者,奥贝胆酸迎来了治疗肝脏疾病的阶段性胜利,也为Intercept拓展NASH领域增添了信心。
PBC是一种肝脏类罕见病,由自身免疫反应引起,会导致肝内胆汁淤积,从而对肝脏造成损害,其渐进性的特点,意味着损害会随着时间的推移而恶化。如不及时治疗,肝脏会经历从炎症到肝纤维化到肝硬化,并最终导致肝功能衰竭的过程。
这一病理过程,与NASH有些许相似之处,奥贝胆酸治疗PBC的成功上市,为治疗NASH提供了借鉴意义,但是,NASH的病理机制更为复杂,使得奥贝胆酸在药物研发、临床试验和申请审批的道路上经历了更多坎坷。
以下是奥贝胆酸研发历程的关键节点:
● 2011年3月,由美国国家糖尿病、消化与肾脏疾病研究所(NIDDK)赞助的FLINT临床试验宣布开启,用于研究奥贝胆酸治疗NASH的疗效。
● 2015年1月,FDA授予Intercept奥贝胆酸治疗NASH肝纤维化的突破性疗法认定,奥贝胆酸成为很长一段时间内唯一获得此认定的NASH新药。
● 2015年12月,Intercept宣布开启奥贝胆酸与他汀类药物联合治疗NASH的前瞻性临床试验,用于评估其治疗NASH患者脂质代谢的效果。
● 2019年9月,Intercept向美国FDA递交奥贝胆酸治疗NASH肝纤维化的NDA申请。申请是基于REGENERATE关键临床III期研究的积极中期分析结果。研究显示,在18个月后,奥贝胆酸25mg剂量对肝纤维化显示出强劲改善且没有恶化,因此到达主要终点。
● 2019年11月,美国FDA受理Intercept 的NDA申请,并授予优先审查权。
● 2020年6月,奥贝胆酸因中期组织学终点数据带来的获益仍具有不确定性,被FDA拒绝加速批准治疗NASH肝纤维化,FDA 建议 Intercept 提交REGENERATE III期临床研究的其他中期疗效和安全性数据。
● 2021年12月,Intercept正式通知欧洲药物管理局(EMA),撤销奥贝胆酸治疗NASH肝纤维化的销售授权申请(MAA),原因为人用药品委员会(CHMP)根据Intercept提交的数据,无法确定奥贝胆酸治疗NASH的积极获益,仍然需要提交额外统计数据。
● 2022年9月,Intercept宣布,在NASH引起的代偿性肝硬化患者中,评估奥贝胆酸安全性和有效性的REVERSE III期临床试验没有到达主要终点,虽然在长达18个月的治疗后,肝纤维化呈现组织学改善,病情没有恶化,但在这些肝硬化患者中没有观察到奥贝胆酸更新的安全信号。
● 2022年11月,Intercept在AASLD肝脏年会上公布奥贝胆酸治疗NASH肝纤维化的REGENERATE III期临床最新数据。数据结果积极,奥贝胆酸25mg剂量减少肝纤维化的反应率是安慰剂的两倍,且NASH症状没有恶化,奥贝胆酸25mg剂量在无肝硬化的晚期纤维化患者中,显示出更强劲的抗纤维化疗效。在安全性上,Intercept对2477名患者进行了强有力的安全性评估,其中1000名患者服用药物的时间长达4年,这支持了奥贝胆酸的安全性和可长期使用的可能。
● 2022年12月,Intercept重新向FDA递交奥贝胆酸治疗NASH肝纤维化的NDA申请,申请基于11月刚公布不久的关键性REGENERATE III期临床研究中两组积极的中期分析数据。
● 2023年1月,FDA再次受理奥贝胆酸治疗NASH肝纤维化的NDA申请,Intercept表示,REGENERATE III期临床研究中的两组积极数据显示,患者服用奥贝胆酸25mg剂量后,用于评估NASH临床表现的三种组织学成分均未出现恶化,这一终点与FDA的指导草案一致,且在安全性上表现良好。
从时间线上来看,Intercept对奥贝胆酸治疗NASH的研究已经持续10余年,不论期间迎接过喜讯还是遭遇过困境,这段历程对整个NASH领域颇有借鉴意义。
一方面,Intercept如今选择再次向FDA递交NDA申请,二次闯关NASH赛道是对FXR靶点治疗潜力的验证;
另一方面,不断出现的挫折虽然让Intercept花费了更多时间去填平踩过的坑,但也给NASH领域的药物研发者们提供了更多药物研发、临床试验设计等方面的新思路。比如,奥贝胆酸虽然有效性显著,但安全性一直被人诟病,因为严重的副作用,FDA甚至让Intercept在药物说明书中加上黑框警告,这将促使其他在研药企开发更具安全性的药物;从奥贝胆酸首次获批失败的案例中可以看出,面对NASH这种多因素、进行性的复杂疾病,药监部门对临床试验终点会有更加严格的规定和把控,因此,这不仅推动了NASH赛道药物靶点选择上的百花齐放,更提升了药企在临床试验设计上的严谨性。
以FXR靶点为核心,适应症持续拓展中
在重点推动奥贝胆酸治疗NASH的进程中,Intercept没有放弃对其他肝脏适应症的拓展。他们进行过多次试水与验证,这导致一些临床试验或管线曾经出现在新闻当中,但最终又消失在产品管线布局图上,比如,Intercept在2013年宣布了奥贝胆酸治疗慢性胆汁酸性腹泻的IIa期临床试验的积极临床结果,但至今没有看到更新进展;2015年,Intercept宣布开启其FXR和TGR5双重激动剂INT-767的I期临床研究,INT-767可以视为奥贝胆酸迭代升级的第二代产品,目前也没有下文。
不过,这些项目都没有脱离Intercept的核心理论基础——靶向FXR受体,他们希望能够通过迭代更新FXR激动剂,在慢性肝脏疾病领域继续大展拳脚。
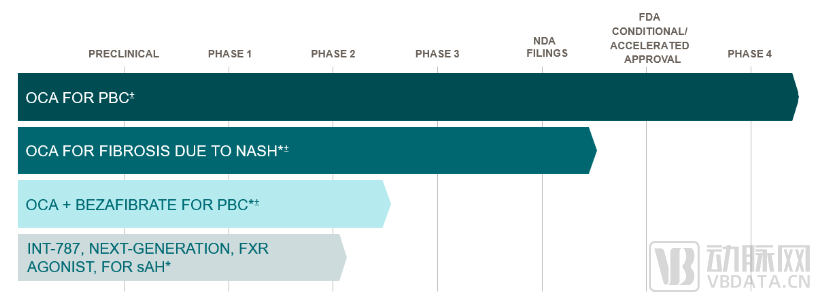
▲ Intercept产品管线,图片来源:Intercept官网
就在2022年,Intercept再次公布了一条新管线TNT-787,公司将其定位为下一代FXR激动剂,用于治疗重度酒精相关性肝炎(sAH)。目前,治疗sAH还没有任何药物获批上市,但美国的相关患者群体不仅更加年轻化,数量也在不断增加。
面对这一未满足临床需求,Intercept介绍,INT-787的水溶性是奥贝胆酸的16倍,在临床前肝病模型中,它调节的基因数量要比奥贝胆酸更多。根据2022年11月在AASLD肝脏年会上公布的临床I期数据,INT-787在健康成人中拥有良好安全性和耐受性,副作用为轻度,无严重不良事件,临床I期将在2023年第一季度完成。同时,Intercept已经发起FRESH临床II期研究,用于评估 INT-787在 sAH 患者中的安全性、耐受性、有效性和药代动力学。
Intercept在慢性肝病领域的探索还将继续,而目前面临的最大挑战便是奥贝胆酸在NASH领域的突破。如果说2016年对于Intercept的发展是个小高峰的话,2023年或许有望让Intercept和整个NASH领域迎来历史性跨越,奥贝胆酸的PDUFA日期在2023年6月22日,让我们静候佳音。
*封面来源:123rf
如果您想对接动脉新医药报道的企业,请扫描小程序码进入VB100人脉圈查看。







 个人中心
个人中心
 我是园区
我是园区








