
1
Avalo宣布用于白细胞黏附缺陷症II型的AVTX-803在关键LADDER试验中完成首例患者给药

Ipsen公布Onivyde® RESILIENT III期研究消极结果
试验结果显示,与托泊替康相比,Onivyde®治疗的患者未满足主要终点OS。然而,观察到客观反应率(ORR)的次要终点翻了一番,有利于Onivyde®。Onivyde®的安全性和耐受性与其已知的安全性一致,并且没有出现新的安全问题。临床研究结果将与监管机构沟通。

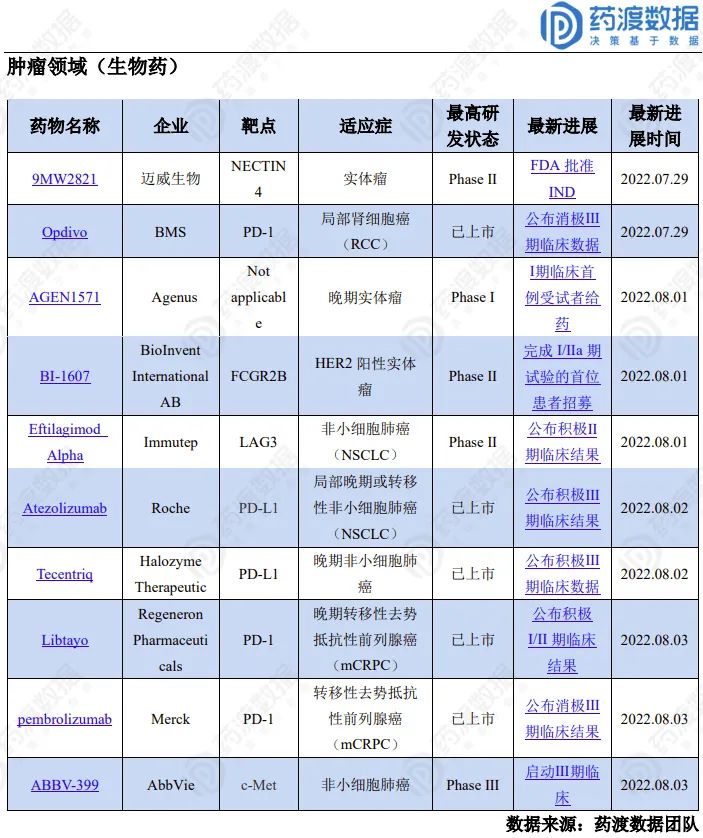
更多具体信息,请联系小编获取
2
2022年7月30日-8月5日,国内新药研发同样突飞猛进,治疗肿瘤的生物药进展迅速。
信立泰1类新药SAL0114片完成I期临床首例受试者入组
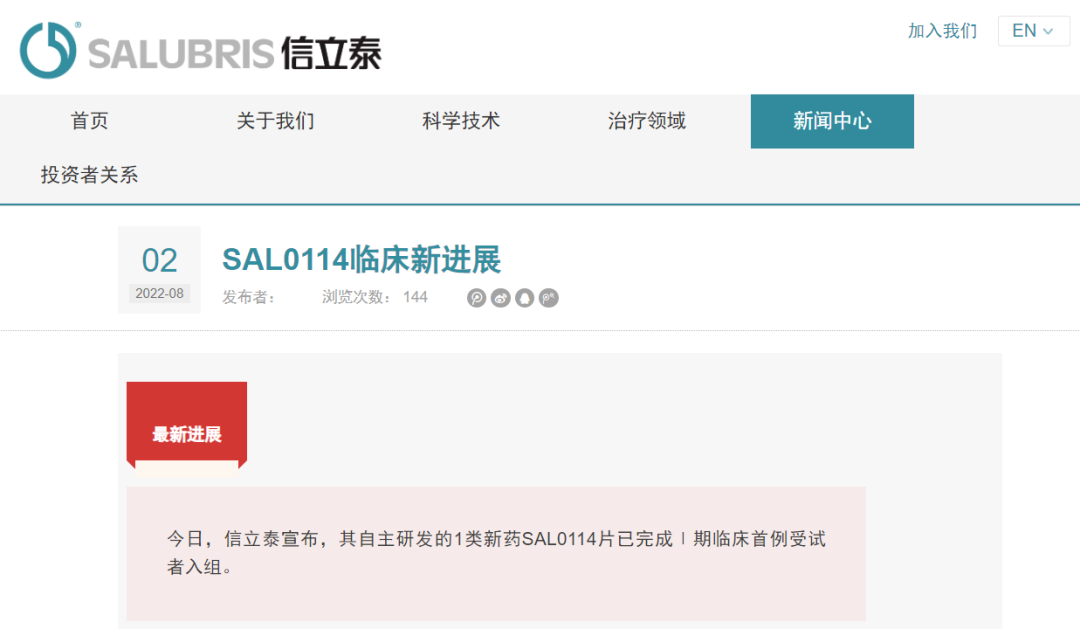
先为达生物公布XW003中国超重和肥胖症1c/2a期临床试验取得积极中期顶线结果
2022年8月2日,先为达生物宣布,XW003(Ecnoglutide)在超重或患肥胖症的中国成人受试者中进行的为期26周的Ic/IIa期临床试验获得了积极的中期顶线结果。XW003是一种新型长效的胰高血糖素样肽-1(GLP-1)类似物,正被开发用于治疗2型糖尿病和肥胖症。
该项Ic/IIa期研究是一项正在中国进行的多中心临床试验,试验对象为非糖尿病的超重或肥胖症成人受试者。该研究由两部分组成:随机、双盲、安慰剂对照的14周核心治疗阶段(第1-14周;A部分),随后是开放标签扩展阶段,受试者将接受研究药物额外的12周治疗(第15-26周;B部分)。在所有受试者完成核心治疗阶段(A部分)后进行中期分析。符合条件的受试者包括体重指数(BMI)介于24.0和35.0 kg/m²之间、非糖尿病的健康成人。参与该研究的60名受试者被随机分为三个研究队列,分别接受1.8 mg、2.4 mg XW003和安慰剂皮下注射,给药频次为每周一次。XW003队列的受试者注射起始剂量为0.3 mg,随后逐步递增至最终随机剂量1.8 mg或2.4 mg。受试者的基线平均体重为84.6公斤,BMI为29.5 kg/m²。
治疗14周后,1.8 mg和2.4 mg XW003队列的受试者平均体重分别下降了8.32公斤(9.6%)和7.27公斤(9.0%),而安慰剂队列的受试者则为0.62公斤(0.9%)。XW003受试者与安慰剂受试者的体重下降差异具有显著统计学意义(P<0.0001)。在14周治疗结束时,1.8 mg XW003队列中72.4%的受试者和2.4 mg XW003队列中66.7%的受试者体重下降超过5%,而安慰剂队列为20%;1.8 mg XW003队列中34.5%的受试者和2.4 mg XW003队列中28.6%的受试者体重下降超过10%,而安慰剂队列为10%。XW003受试者的腰围、臀围和腰臀比也发生了具有显著统计学意义的降低,并在代谢参数方面也观察到了有利的变化趋势,包括空腹血糖、甘油三酯、低密度脂蛋白和HbA1c(糖化血红蛋白)。
与之前的研究一致,XW003总体上呈现出良好的安全性和耐受性。没有与治疗相关的严重不良事件(SAE)和3级或更高级别的不良事件发生。与治疗相关的不良事件为轻度至中度,最常报告的是胃肠道副作用。研究过程中未发生因与研究药物相关的不良事件而停药。
关于XW003
胰高血糖素样肽-1(GLP-1)受体激动剂在临床上已经用于治疗2型糖尿病和肥胖症,并显示出治疗非酒精性脂肪性肝炎(NASH)的潜力。XW003是一种新型、具有偏向性的长效GLP-1受体激动剂。XW003在国内已获得2型糖尿病、体重管理、NASH三项临床批件,其中,2型糖尿病和体重管理适应症已快速推进至II期,预计2022年年底进入关键性III期临床研究。
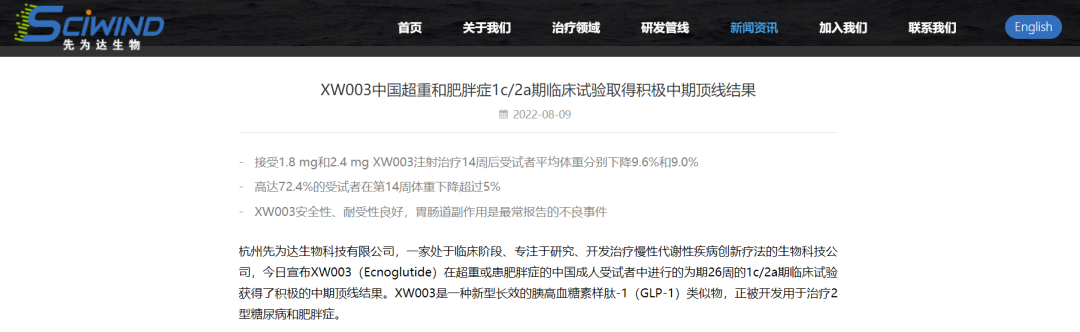
2022.07.30-08.05国内新药研发进展(部分)
3
2022.07.30-08.05临床默示许可进展(部分)
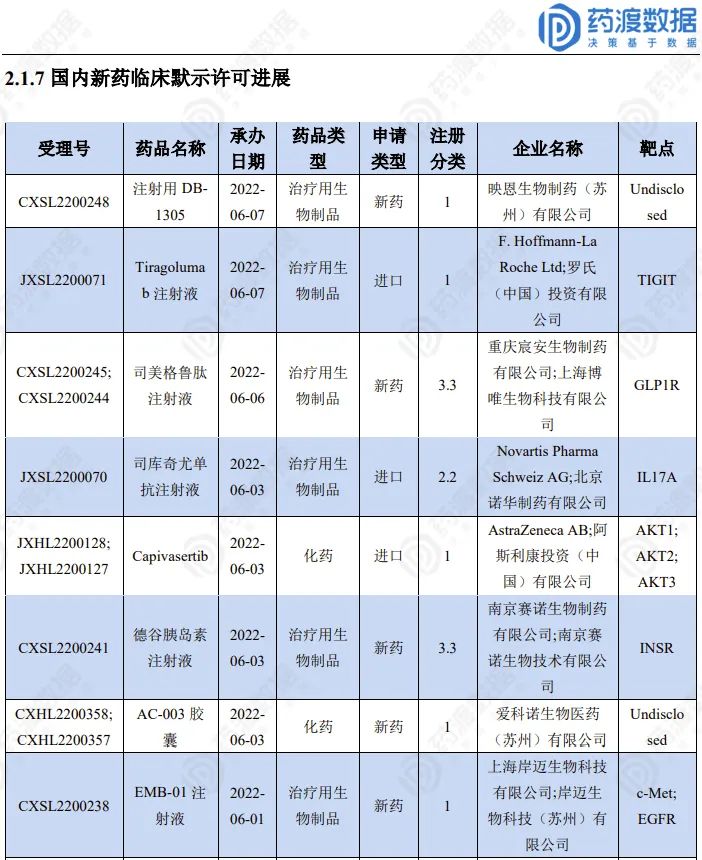
更多具体信息,请联系小编获取
4
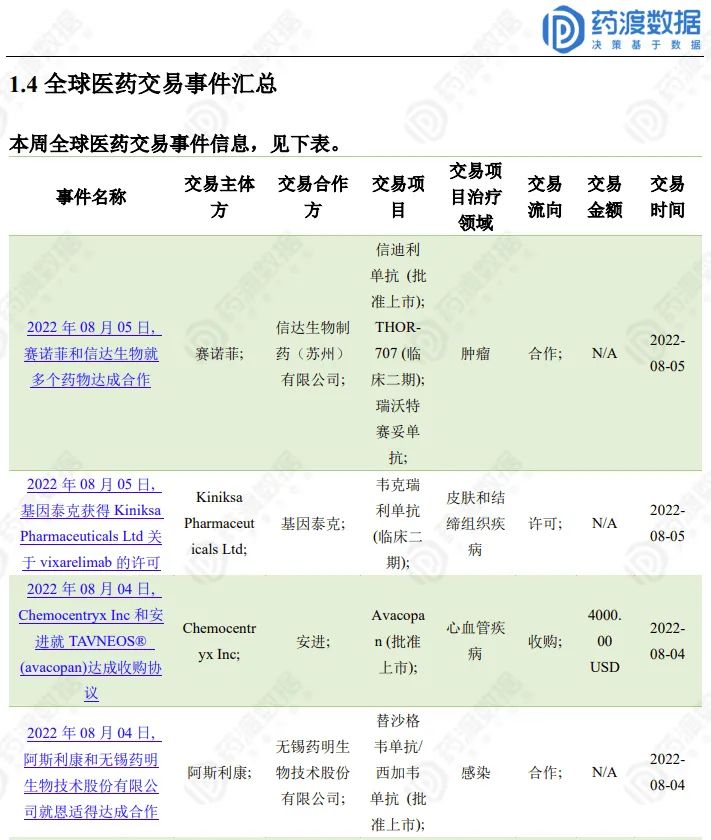
全球医药交易事件
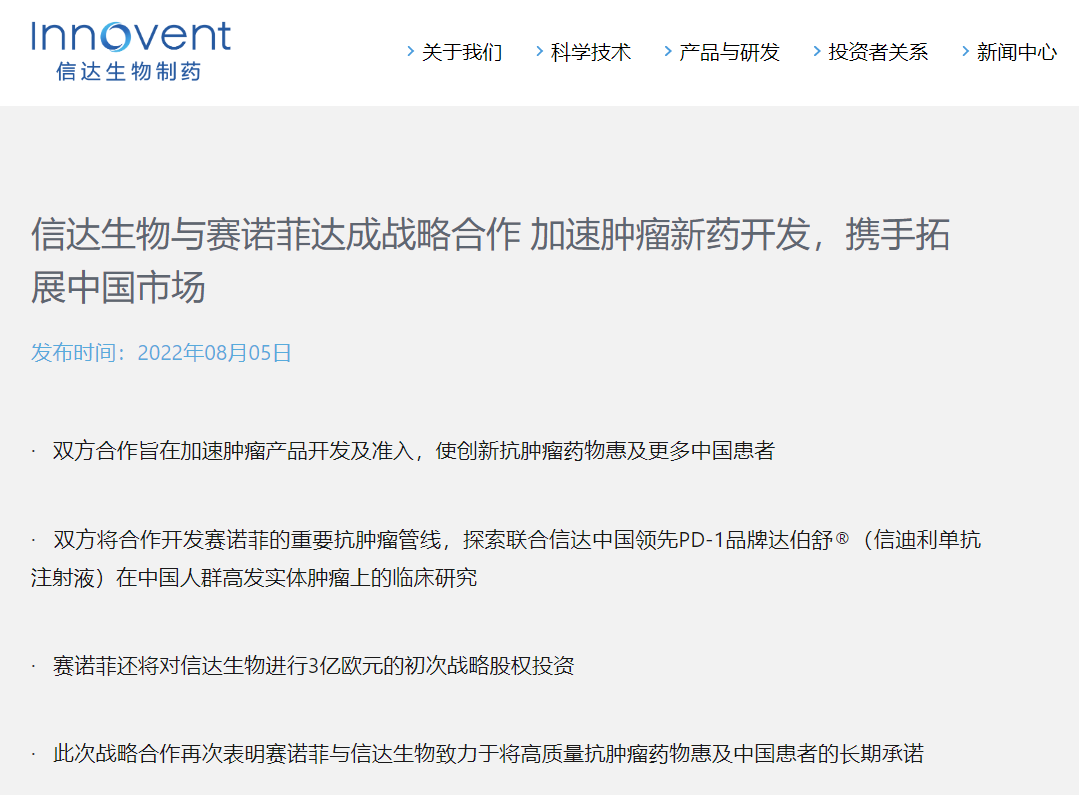
信达生物与赛诺菲达成战略合作 加速肿瘤新药开发,携手拓展中国市场
Tusamitamab ravtansine的开发和商业化合作
SAR408701(tusamitamab ravtansine)是潜在同类首创(First-in-Class)的抗体-药物偶联物(ADC),靶向癌胚抗原相关细胞粘附分子5(CEACAM5),一种在非小细胞肺癌、胃癌和其他癌症中高度表达的细胞表面糖蛋白。目前,SAR408701正在全球范围内开展二线非小细胞肺癌III期临床研究,以及一线非小细胞肺癌、胃癌和其他实体肿瘤的全球临II期研究。
信达生物将负责tusamitamab多个肿瘤适应症在中国的临床开发和独家商业化。赛诺菲将有权获得累计最高达8,000万欧元的潜在里程碑付款,以及该产品在中国获批上市后基于净销售额的特许权使用费。
SAR444245的开发和商业化合作
SAR444245是一种潜在同类首创(First-in-Class)、定点PEG修饰、工程化、重组人源IL-2(rIL-2)的变体,其半衰期延长,能特异性地与低亲和力的IL-2受体βγ链结合,同时缺乏与高亲和力IL-2受体α链的结合。SAR444245(IL-2)目前正在皮肤癌、胃肠癌、非小细胞肺癌/间皮瘤、头颈癌和淋巴瘤等适应症上开展全球临床II期研究。
信达生物和赛诺菲将共同探索SAR444245多个癌种在中国的开发,并由信达生物主导临床开发。赛诺菲将继续作为以上两款肿瘤产品的药品上市许可持有人(MAH)并负责SAR444245的商业化。信达生物将有权获得累计最高达6,000万欧元的潜在里程碑付款,以及该产品在中国获批上市后基于净销售额的特许权使用费。
赛诺菲对信达生物进行3亿欧元的初次股权投资
除产品管线的战略合作外, 在满足监管审批和其他常规交割的条件下,赛诺菲将按照截至协议签署前一天(2022年8月3日),过往30个交易日内信达生物平均股价溢价20%的价格,即每股42.42港元,以新股认购方式购入价值3亿欧元的信达生物普通股份。
未来基于双方一致同意的条件下,赛诺菲有权额外购入价值3亿欧元的信达生物普通股份。认购价格将为较信达生物截止另行协议约定时间的30个交易日内平均股价溢价20%。
阿斯利康与药明生物达成新冠预防中和抗体恩适得本地化生产战略合作
阿斯利康新冠预防中和抗体组合药物于去年底在美国获得应急使用授权,于今年3月在欧盟获得上市许可及在英国获得有条件上市许可,于今年5月获得香港卫生署有条件批准,并于今年6月通过乐城先行区特殊进口审批,用于新冠病毒暴露前预防。目前该药物已在全球多个国家获批并供应。

来源:阿斯利康官网
2022.07.30-08.05全球医药交易(部分)
声明:药渡数据出品,未经允许禁止转载




 个人中心
个人中心
 我是园区
我是园区




