
乳腺癌是世界上最常见的三种癌症之一;美国约有380万女性有乳腺癌病史,其中2019年新增病例26.86万例。三阴性乳腺癌(Triple negative breast cancer,TNBC)是乳腺癌最具攻击性的亚型,但目前尚无有效的靶向治疗方法。
三阴性乳腺癌(TNBC)占所有乳腺癌的15%,占所有BC相关死亡的25%,其特征是ER、PR和HER-2表达缺失,对内分泌治疗和HER-2靶向治疗反应较差。与其他亚型相比,TNBC治疗方案有限,是一种预后最差的特殊类型乳腺癌。
单靶点药物开发正面临着疗效差、耐药、毒副作用大等挑战;双靶点药物、药物重组和组合策略,可能为改进TNBC疗法提供新的解决方案。本文综述了小分子药物治疗TNBC的研究现状,包括单靶点药物、双靶点药物,以及药物组合策略等。

根据基因表达特征和生物学功能,TNBC可分为基底样1 TNBC(BL1)、基底样2 TNBC(BL2)、免疫调节TNBC(IM)、间充质样TNBC(M)、间充质干样TNBC(MSL)、管腔雄激素受体TNBC(LAR)等。
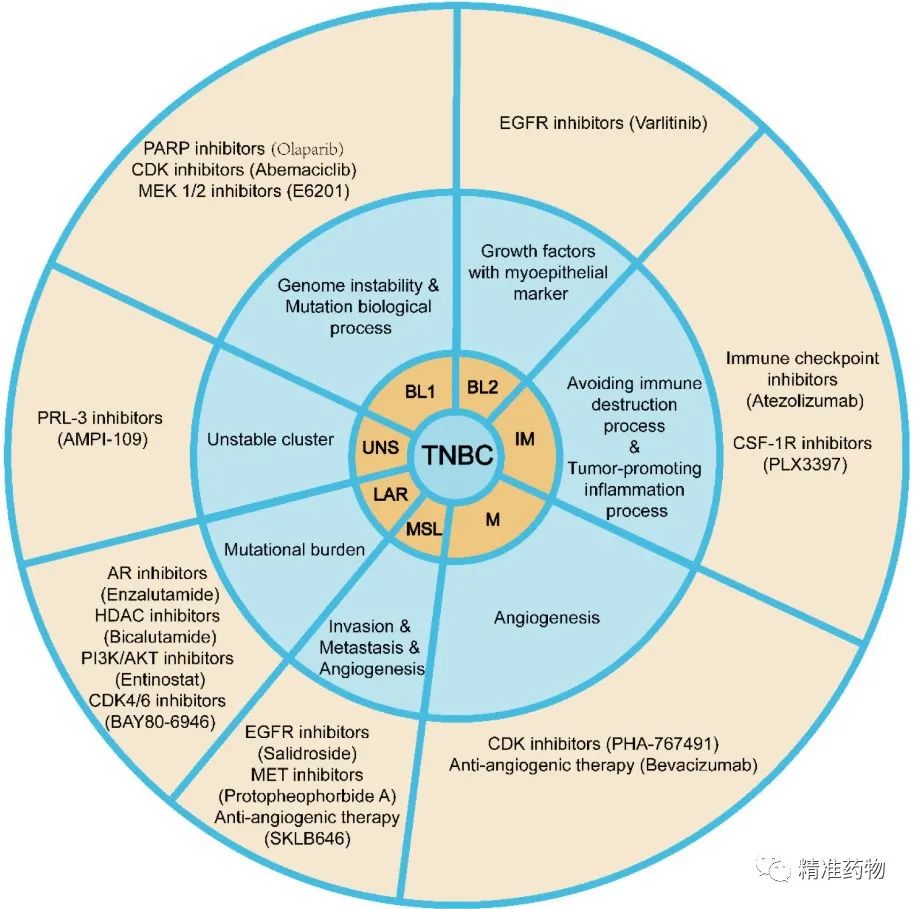
TNBC不同组织分型,表现出特出的基因异常,具体见下表。根据具体基因分型不同,部分BL1 TNBC对PARP抑制剂敏感;部分BL2 TNBC对MET和EGFR抑制剂敏感;部分M TNBC和MSL TNBC对PI3K/AKT抑制剂敏感;部分IM TNBC对免疫治疗敏感;部分LAR TNBC对AR拮抗剂和CDK抑制剂敏感。但仍有众多TNBC患者尚未找到合适的治疗策略。



据统计,小分子药物占常用药物总量的98%,抗肿瘤药物占50%。2018年,美国食品药品监督管理局(FDA)共批准59种新药,其中小分子药物占64%。与传统细胞毒药物不同,小分子靶向药物往往靶向肿瘤细胞特有功能蛋白,往往具有较高的肿瘤选择性和活性,较低的正常细胞毒性。
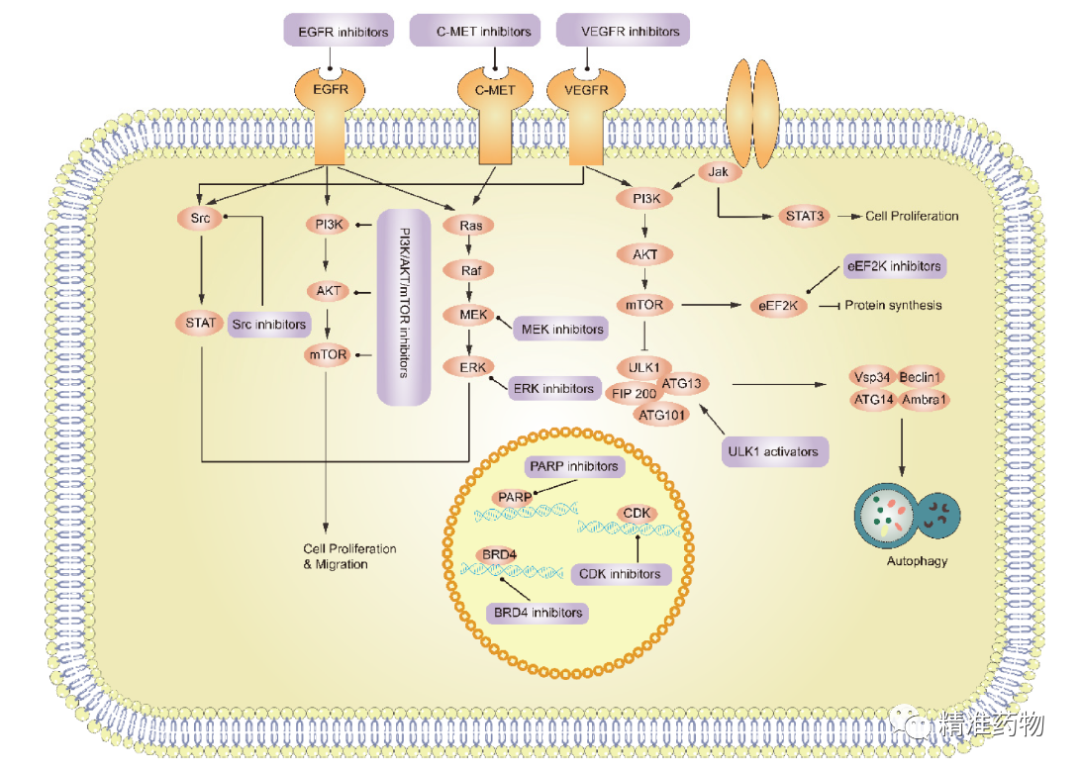
TNBC的潜在小分子靶向治疗靶标

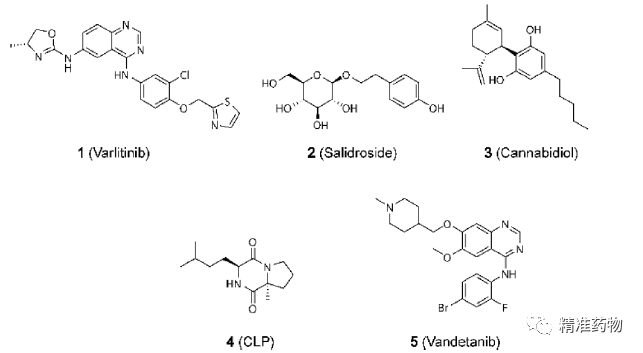

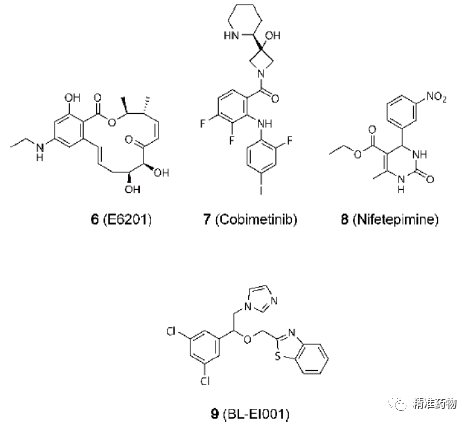
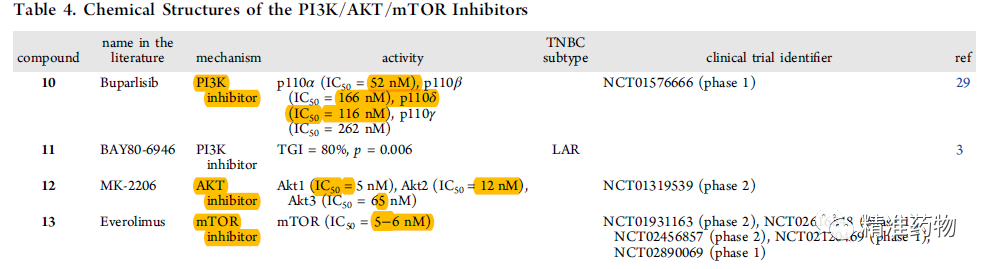
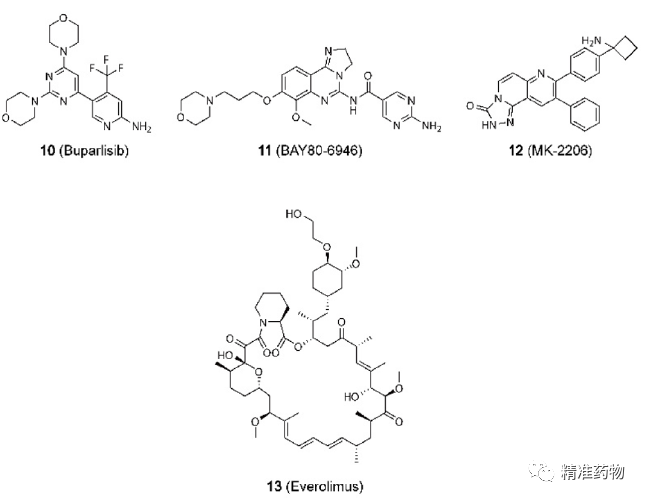
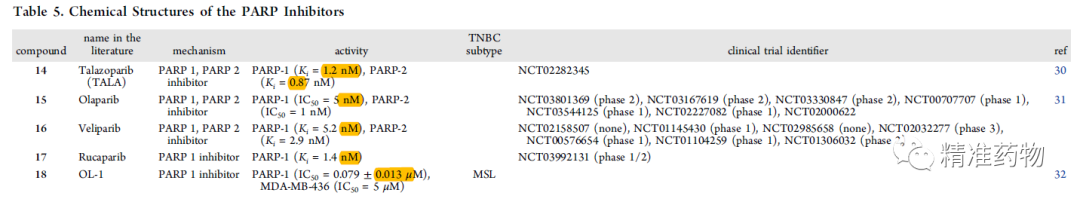
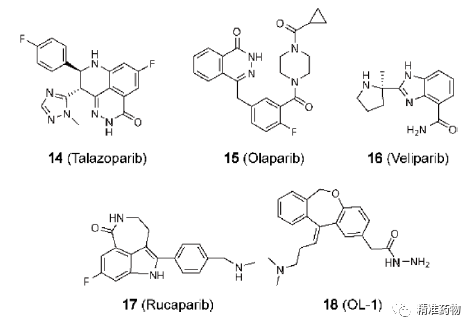

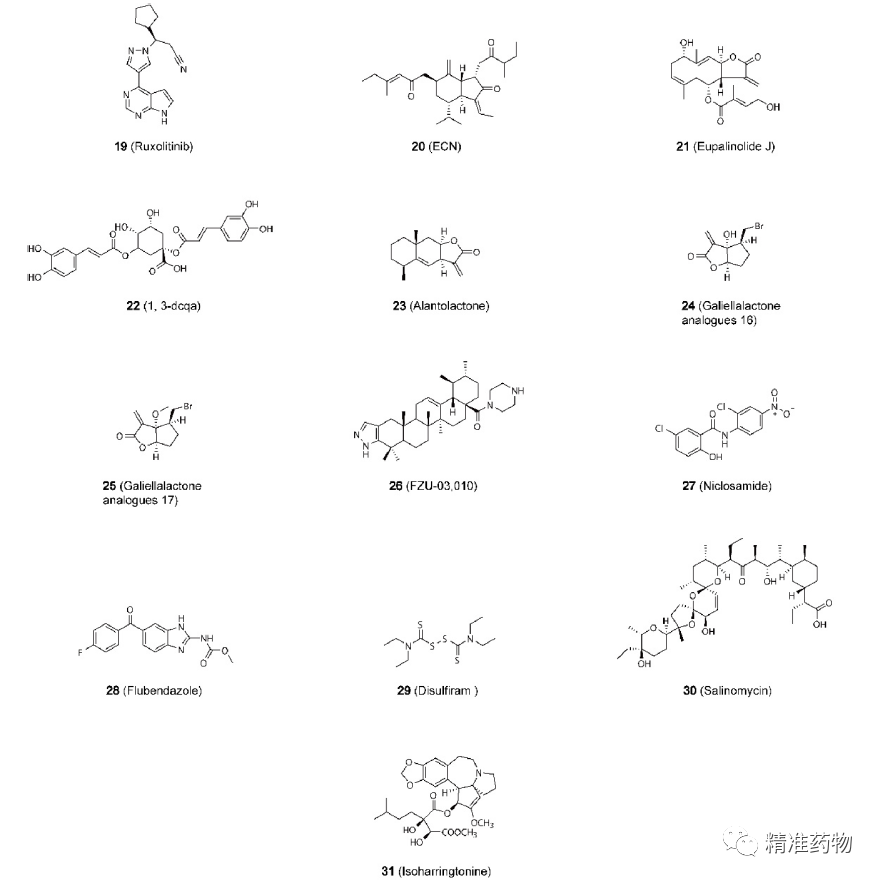
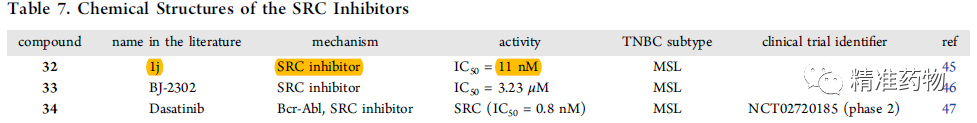
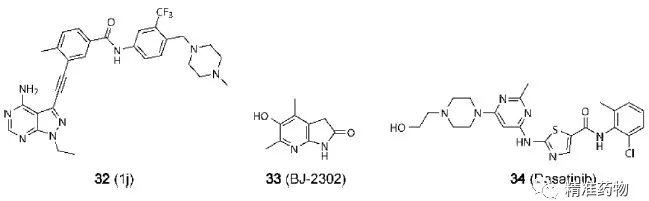

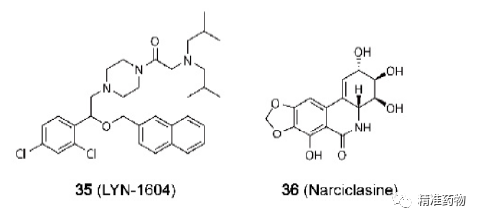

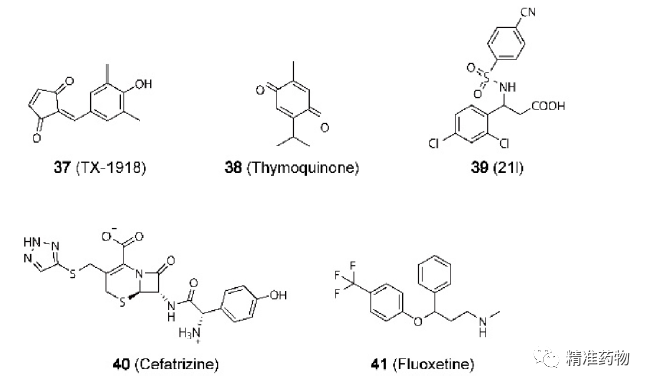
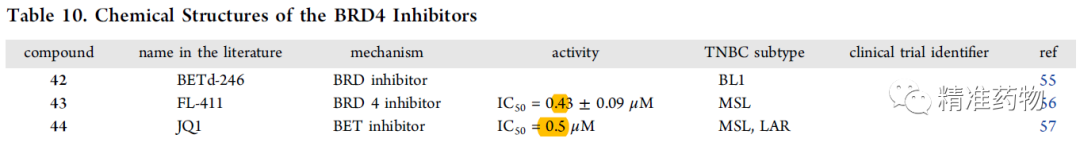
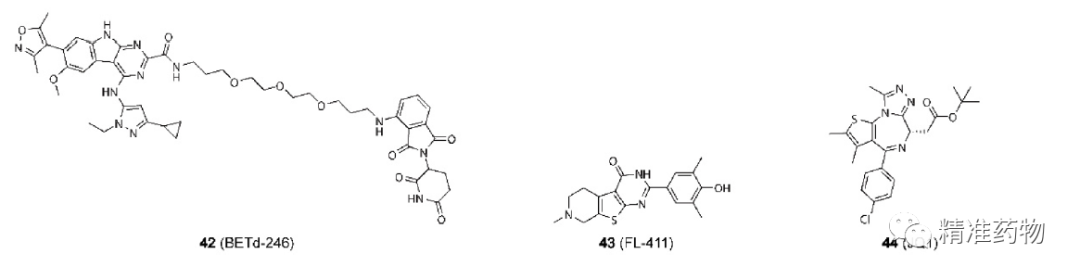
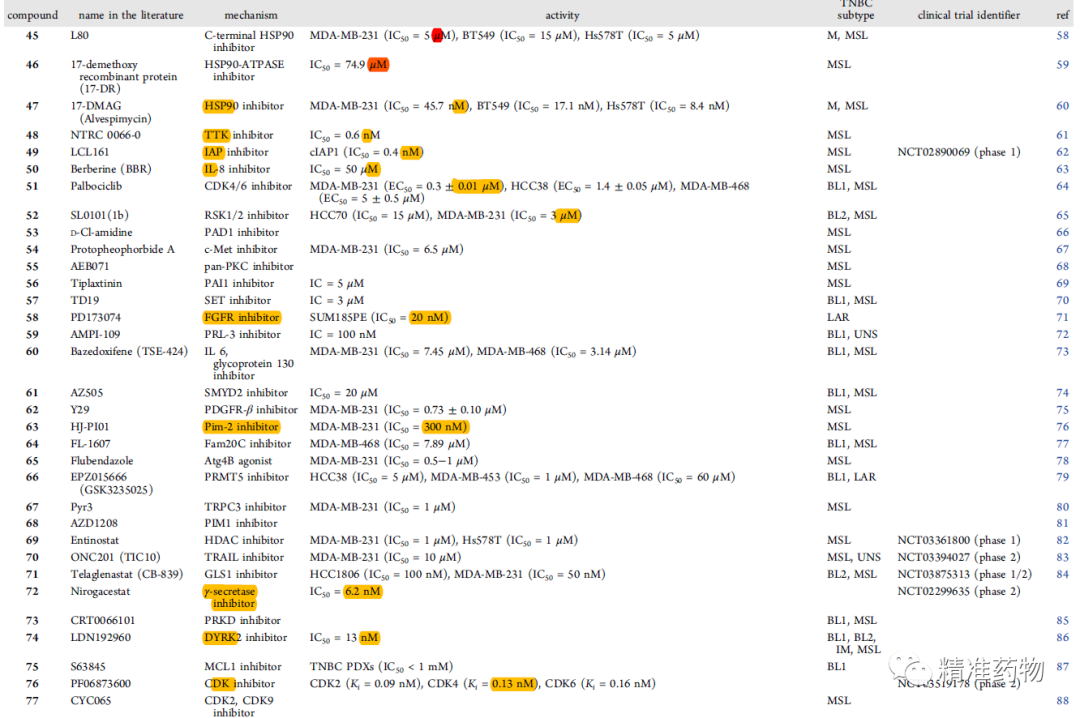




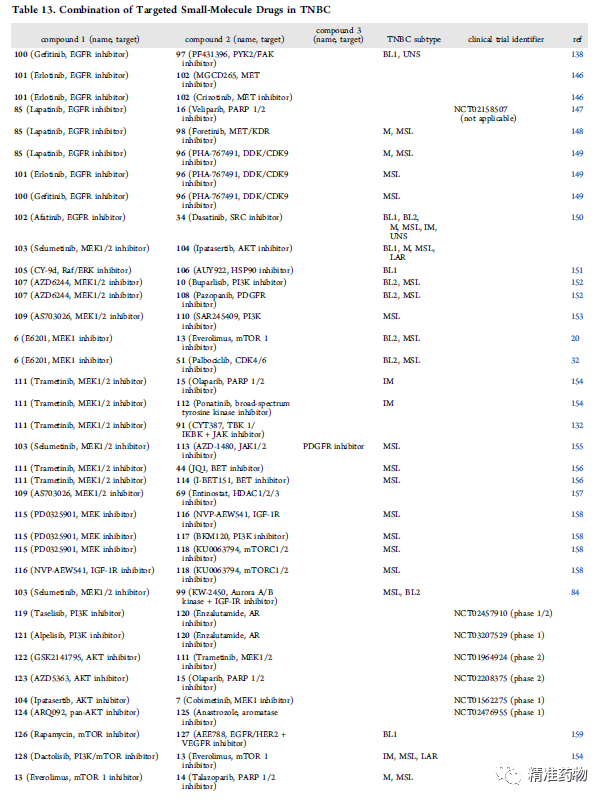
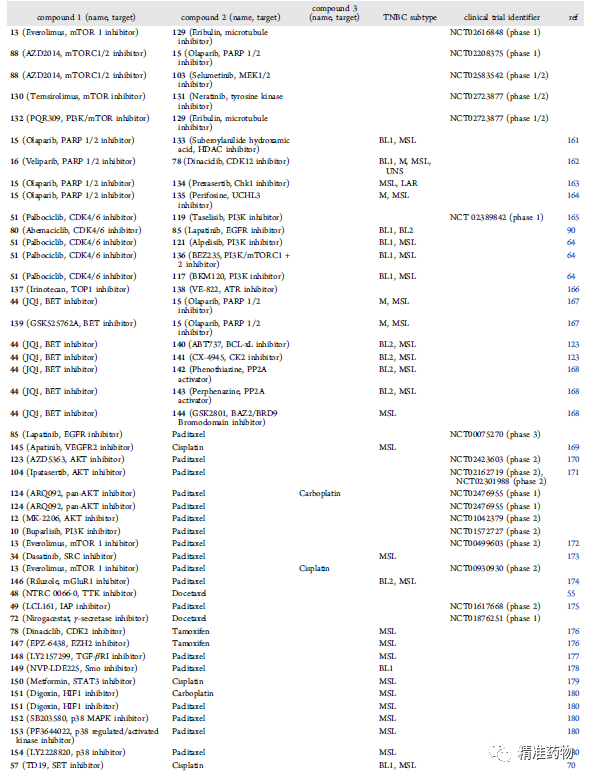
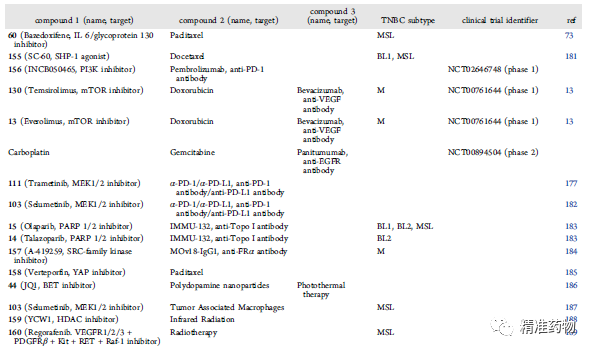


参考资料:https://doi.org/10.1021/acs.jmedchem.0c01180



 个人中心
个人中心
 我是园区
我是园区




