
C型尼曼匹克病(NPC)是一种与溶酶体脂质异常贮积相关的神经退行性疾病。95%的NPC患者是由于溶酶体膜蛋白NPC1基因突变所致。溶酶体是降解清理细胞内有害垃圾的主要细胞器,是维持细胞稳态的重要组成部分。NPC1基因缺陷可引起细胞内脂质转运障碍,导致大量游离胆固醇在溶酶体中沉积并影响自噬溶酶体形成。NPC在神经系统中的主要早期病变是由溶酶体功能缺陷导致轴突肿胀和神经元退化死亡。然而其在神经系统中的疾病发生机制尚不清楚。
2021年4月19日,美国国立健康研究院(NIH)盛祖杭团队在Developmental Cell发表了题为Lipid-mediated motor-adaptor sequestration impairs axonal lysosome delivery leading to autophagic stress and dystrophy in Niemann-Pick type C的研究成果。该项研究发现了神经系统中NPC的病理新机制:胆固醇在溶酶体膜表面过量积累引起运输马达蛋白Kinesin-1和介导蛋白Arl8异常非功能性募集,从而降低溶酶体由胞体向轴突远端运输效率,引起轴突内自噬清理功能缺失并导致神经元轴突退化。

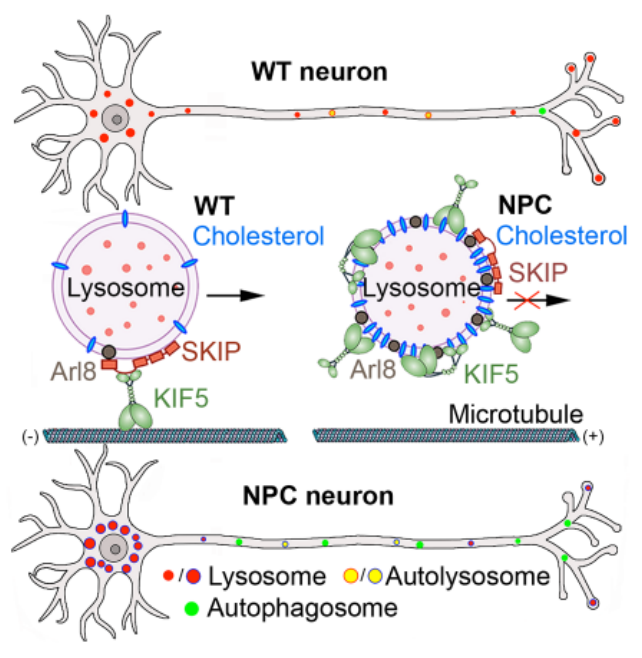
该研究的四项主要发现包括:
1.通过透射电子显微镜揭示了NPC1 敲除(Npc1-/-)小鼠的dorsal root和cortex两个脑区轴突内出现大量自噬细胞器。同时,取自成年鼠的体外培养神经元中进一步证实大量自噬体在轴突内异常堆积。
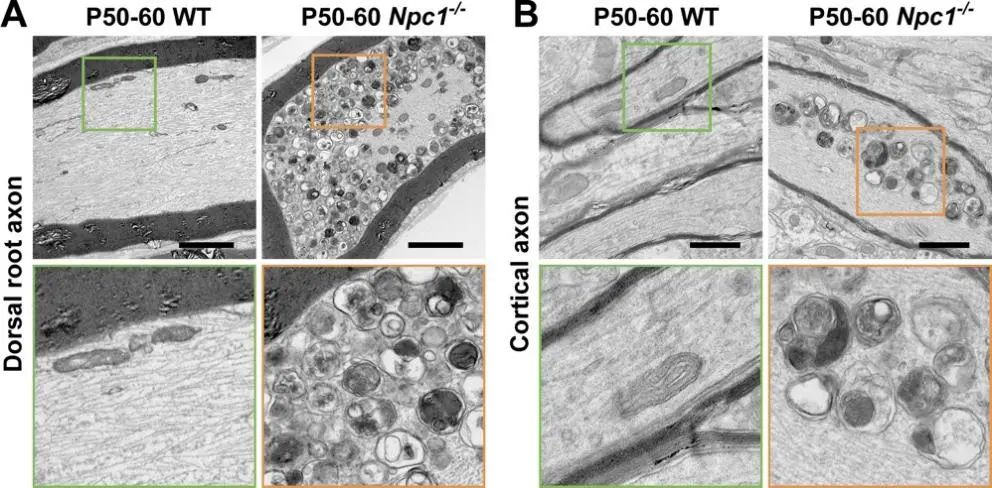
2.通过标记活性溶酶体蛋白酶GCase,Cathepsin D和膜蛋白Lamp1,该研究发现Npc1-/-小鼠轴突内成熟溶酶体的密度显著降低,但是细胞胞体内溶酶体总量增加。活细胞成像结果显示在Npc1-/-小鼠中,溶酶体从胞体向远端轴突的正向运输受阻。
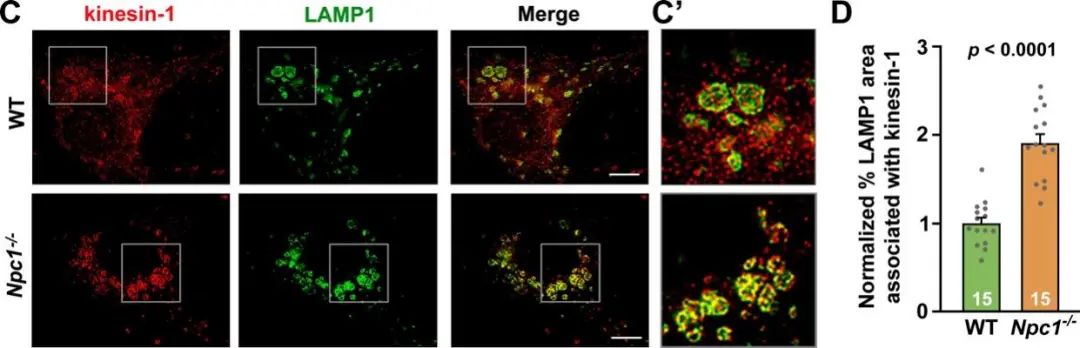
3.为了探索运输受阻机制,盛祖杭团队应用STED超高分辨率成像技术发现Npc1-/-小鼠神经元胞体内溶酶体膜表面胆固醇大量积累并异常地募集马达动力蛋白(motor)kinesin-1和介导分子(adaptor)小GTP酶Arl8在溶酶体膜表面。从而导致Kinesin-1和Arl8不能有效地传递运输溶酶体至轴突远端,进而阻止了溶酶体在轴突中发挥清除垃圾废物的功能。
4. 该研究进一步发现应用FDA批准的降胆固醇化学药制剂2-hydroxypropyl-b-cyclodextrin(HPCD)能够显著降低Npc1-/-小鼠溶酶体膜表面的胆固醇水平,进而抑制kinesin-1和Arl8异常堆集,恢复轴浆溶酶体运输和轴突内的自噬清理功能,进而修复神经元凋亡。该结果为降胆固醇药物HPCD在早期治疗中的应用提供了生物学依据。
总之,该研究首次揭示了胆固醇在溶酶体膜上堆积导致轴浆运输障碍引起神经元轴突退化死亡的重要机制。溶酶体表面脂质积累导致控制溶酶体轴浆运输动力蛋白和介导分子在溶酶体表面异常非功能性富集,从而损伤溶酶体轴突转运机制,进而导致轴突退化和神经细胞凋亡。此项研究不仅揭示了NPC在神经系统中的致病新机制,也为NPC早期治疗提供了新思路和新靶标。
盛祖杭为该项研究的通讯作者,第一作者Joseph Roney是NIH-剑桥牛津联合计划的博士研究生,师从盛祖杭与牛津Frances Platt,第二作者李苏楠博士完成了STED超高分辨成像实验,为机制研究作出了重要贡献。盛团队的博后包括Tamar Farfel-Becker, 黄宁,孙涛,谢渝湘,程秀唐,Mei-Yao Lin也参与了此项研究并作出了贡献。
盛祖杭团队近年来系统地研究神经元溶酶体自噬体运输与神经系统功能与稳态调节(Cai et al., Neuron 2010; Cai et al., Current Biology, 2012; Cheng et al., JCB 2015; Di Giovanni and Sheng, EMBO J 2015; Xie et al., Neuron 2015; Cheng et al., JCB 2018; Farfel-Becker et al., Cell Reports 2019),此前多项发表的工作为此项疾病机制研究打下了坚实基础。也是他们系统工作的一部分.
原文链接:
https://doi.org/10.1016/j.devcel.2021.03.032
参考文献
1. Cai, Q., L. Lu, J.-H. Tian, Y.-B. Zhu, H. Qiao, and Z.-H. Sheng (2010). Snapin-regulated late endosomal transport is critical for efficient autophagy-lysosomal function in neurons. Neuron 68, 73-86.
2. Cai, Q., H. M. Zakaria, A. Simone, and Z.-H. Sheng (2012). Spatial Parkin Translocation and Degradation of Depolarized Mitochondria via Mitophagy in Live Cortical Neurons. Current Biology 22, 545-552.
3. Cheng, X.-T., B. Zhou, M.-Y. Lin, Q. Cai, and Z.-H. Sheng (2015). Axonal autophagosomes acquire dynein motors for retrograde transport through fusion with late endosomes. Journal of Cell Biology 209, 377-386.
4. Di Giovanni, J., and Z.-H. Sheng (2015). Regulation of synaptic activity by snapin-mediated endolysosomal transport and sorting. EMBO Journal 34, 2059-2077.
5. Xie* Y, Zhou B* (equal contributions), Lin M-Y, Wang S, Foust K D, and Sheng Z-H. (2015). Endolysosome deficits augment mitochondria pathology in spinal motor neurons of asymptomatic fALS-linked mice. Neuron 87, 355-370.
6. Cheng X-T, Xie Y, Zhou B, Huang N, Farfel-Becker T, and Sheng Z-H (2018). Characterization of LAMP1-labeled non-degradative lysosomal and endocytic compartments in nervous systems. Journal of Cell Biology 217, 3127-3139.
7. Farfel-Becker T, Roney J C, Cheng X-T, Li S, Cuddy S R, and Sheng Z-H. (2019). Neuronal soma-derived degradative lysosomes are continuously delivered to distal axons to maintain local degradation capacity. Cell Reports 28, 51-64.
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




