国内首款!8.3亿美元引进,云顶新耀Trop-2-ADC获批上市
收藏
关键词:
上市获批
资讯来源:药渡 + 订阅账号
发布时间:
2022-06-12

近日(2022年6月10日),据NMPA官网最新公示,
云顶新耀引进Trop-2-ADC药物(注射用戈沙妥珠单抗)获得批准上市
,用于2线+转移性三阴性乳腺癌(mTNBC)治疗。这也是
国内首款获批上市的Trop-2-ADC药物
。
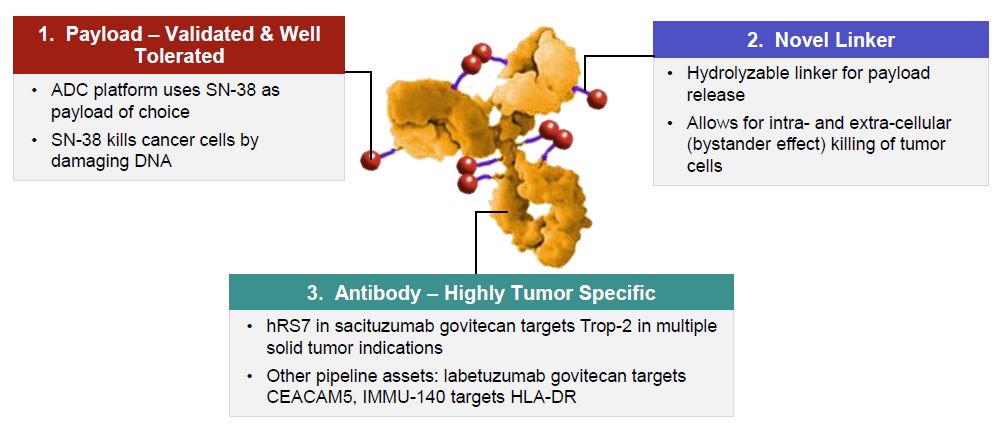
Trodelvy是一款靶向Trop-2-ADC药物,由人源化抗体hRS7作为靶向载体与伊立替康活性代谢产物SN38偶联而成,由Immunomedics开发。2019年4月,云顶新耀与Immunomedics达成授权协议,以8.3亿美元获得了Trodelvy在大中华区、韩国及部分东南亚国家的独家权益。
2020年4月22日,基于IMMU-132-01试验,Trodelvy获得FDA加速批准上市,用
治疗2线+ mTNBC,为全球首款获批上市的TROP-2-ADC药物。很快,作为摘得首款TROP-2靶向药桂冠的Immunomedics吸引到了吉利德的注意。2020年9月,吉利德210亿美元收购Immunomedics,获得了该款领先产品。后续Trodelvy的监管审批也很给力,不到一年时间(
2021年4月),2L+
mTNBC就获得了转正批准,同月,
Trodelvy便斩获第二个适应症
--
2/3L线
局部晚期或转移性尿路上皮癌
。
随着Trodelvy的市场顺利推进,Trodelvy的销售额也稳步上升。2020年Trodelvy销售额达1.17亿美元(Q3-Q4),2021年3.8亿美元。据去年Nature Reviews Drug Discovery预测,2026年,Trodelvy的全球销售额将达到11亿美元。
目前,云顶新耀已在多个国家/地区寻求上市批准。今年1月6日,云顶新耀向新加坡卫生科学局提交Trodelvy的新药上市申请已经获得批准(2线+mTNBC患者)。
另外,
云顶新耀还在
与
韩国的监管机构
进行密切沟通
,以对
Trodelvy
进行申报审批。
2021年12月,韩国食品药品安全部 (MFDS)接受了Trodelvy的新药申请 (NDA)(
T
rodelvy此前
曾在韩国
获得快速通道指定和孤儿药指定)。
2021年12月,中国台湾食品药品监督管理局接受了Trodelvy的上市申请,
Trodelvy此前已获得了中国台湾获得儿科和罕见严重疾病优先审查
指定。
Trodelvy上市之后,TROP2靶点开始备受关注,
走入大众视野。目前,TROP2-ADC赛道已聚集了多家国内布局企业,杭州多禧生/君实、科伦药业、复旦张江、恒瑞医药、百利药业
等多家药企加入。
不过,
大多数
处于同一起跑线。科伦药业--SKB264此前被业内人士推测有望是首个国产上市TROP2-ADC。
三阴乳腺癌属于进展快,侵袭性强的难治性肿瘤类型,Trodelvy针对三线三阴乳腺癌依然表现出颠覆性疗效,先前也因为Ⅲ期疗效突出提前终止临床。最近刷屏的DS8201也体现了ADC在针对难治肿瘤的非凡疗效。未来随着更多高效偶联药物的出现,ADC药物也有望在末线/复发难治肿瘤治疗方面期待有更好的发挥,在人类与肿瘤等疾病的斗争中扮演更为重要的角色。
“药渡”公众号所转载文章来源于其他公众号平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。



 药选址
药选址



