
2021年4月21日/医麦客新闻 eMedClub News/--2021年4月19日,Agenus宣布已经向美国FDA递交了PD-1抗体Balstilimab的上市申请,用于治疗复发性或转移性宫颈癌,并获得加速审评资格。
本次申请基于对ESMO 2020上提交的数据,总体数据显示,PD-L1阳性肿瘤的缓解率为20%,所有肿瘤(PD-L1阳性和阴性)的缓解率为15%,中位反应持续时间为15.4个月。
Balstilimab是Agenus开发的全人源的PD-1单克隆抗体,具有阻断PD-1与其配体(PD-L1、PD-L2)结合的能力。其主要作用机制是针对PD-1或其配体设计特定的蛋白质抗体,这些抗体可以与PD-1或其配体结合,阻断T细胞表面的PD-1与其在肿瘤细胞表面的配体间的相互作用,恢复T细胞的功能,进而增强T细胞杀死肿瘤细胞的作用。同时,它是一种有效的PD-1拮抗剂抗体,可以激活免疫系统以攻击肿瘤。
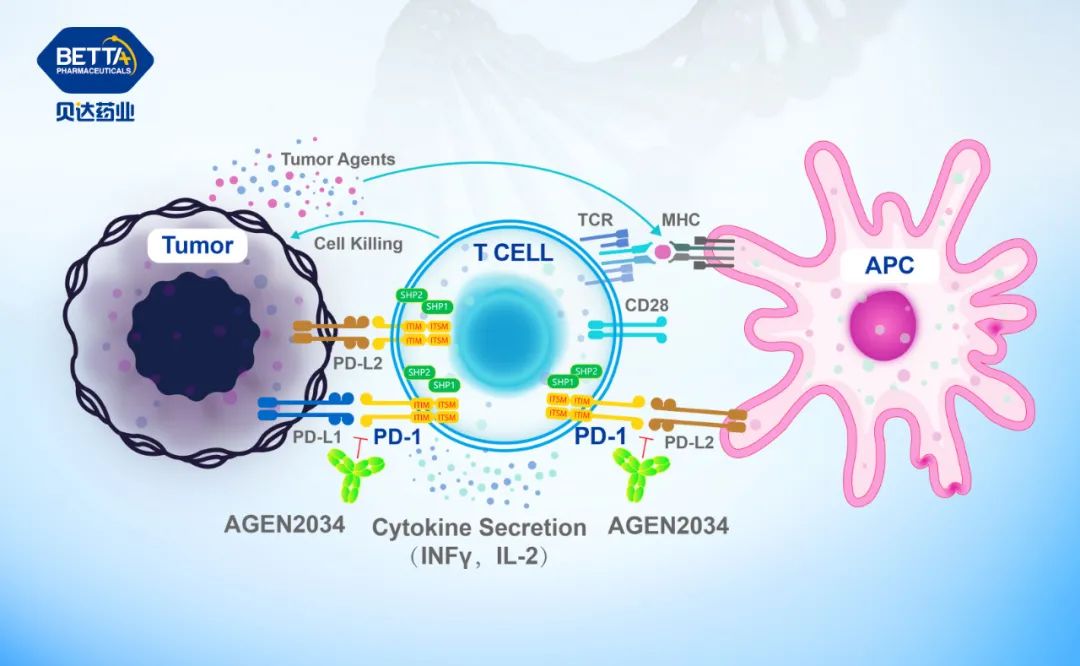
巴替利单抗(PD-1抗体)作用机理图
2020年6月,贝达与美国公司Agenus达成合作,支付Agenus公司1500万美元首付款,同时贝达投资以2000万美元现金认购Agenus增发的股份,贝达药业取得在中国区域内单用或联用治疗除膀胱内给药外的所有肿瘤学和非肿瘤学适应症的独家开发并商业化Balstilimab(PD-1抗体)和 Zalifrelimab(CTLA-4抗体)的权利。
Balstilimab(PD-1抗体)单药或Balstilimab(PD-1抗体)联合泽弗利单抗(CTLA-4抗体)拟用于晚期宫颈癌患者的治疗。
值得关注的是,2021年3月24日国家药监局药品审评中心(CDE)官网公示,贝达药业股份有限公司申报的“巴替利单抗注射液”临床试验申请获得受理(受理号:JXSL2100044)。

▲ 图片来源:CDE
希望Balstilimab能够为复发或转移性宫颈癌患者的带来更多治疗的可能性,缓解疾病带来的痛苦,我们一同期待。



 点击“阅读原文”,立即报名!
点击“阅读原文”,立即报名!



 个人中心
个人中心
 我是园区
我是园区




