速递!复宏汉霖抗PD-L1/TIGIT双抗获批临床
收藏
关键词:
获批临床
资讯来源:医药观澜 + 订阅账号
发布时间:
2022-03-16
▎药明康德内容团队报道
3月15日,中国国家药监局药品审评中心(CDE)官网公示显示,复宏汉霖申报的HLX301临床试验申请已获得默示许可,拟定适应症为局部晚期/转移性实体瘤或淋巴瘤。根据复宏汉霖公开资料,HLX301是该公司开发的一款重组人源抗PD-L1/TIGIT双特异性抗体,已经在澳大利亚获批开展1期临床研究,并于近日完成了首例受试者给药。
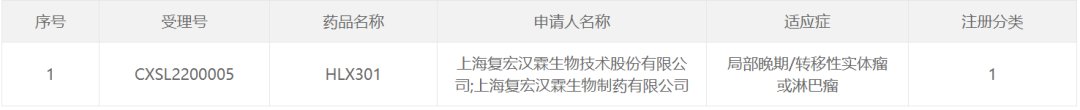
截图来源:CDE官网
T细胞免疫球蛋白和ITIM结构域(TIGIT)是一种抑制性受体,是主要在T细胞和NK细胞表面表达的免疫检查点抑制剂。作为免疫检查点蛋白,TIGIT可通过多种作用机制抑制固有和适应性免疫,在肿瘤免疫抑制中的“踩刹车”作用和PD-1/PD-L1类似。研究发现,抑制TIGIT靶点为从免疫抑制肿瘤微环境中拯救免疫细胞提供了潜在的作用机制。同时,TIGIT通路被认为可与PD-1通路协作,最大程度抑制效应肿瘤浸润免疫细胞。
据复宏汉霖公开资料介绍,临床前研究结果表明,对比抗PD-L1单抗、抗TIGIT单抗以及两种单抗的联合疗法,HLX301可与人PD-L1和TIGIT特异性结合并同时阻断PD-1/PD-L1和TIGIT/PVR负向信号通路,抑制肿瘤细胞的生长,且耐受性、安全性良好,体现了双抗疗法的协同增强效应,有望用于多种晚期肿瘤的治疗,包括非小细胞肺癌、头颈部鳞状细胞癌、食管鳞癌等。

2月14日,复宏汉霖宣布HLX301的1期临床研究在澳大利亚完成首例受试者给药。据介绍,该研究是一项在既往标准治疗失败、不耐受或无合适标准治疗的局部晚期或转移性实体瘤患者中开展,旨在评估HLX301的安全性、耐受性、药代动力学及初步抗肿瘤疗效的多中心、首次人体1期临床试验。其中1a期为剂量递增阶段,主要终点为评估HLX301的安全性、剂量限制毒性(DLT),并确定最大耐受剂量(MTD);1b期为剂量拓展阶段,主要终点为2期临床试验推荐剂量(RP2D)。
本次HLX301在中国获批临床,意味着该药的临床开发迎来又一进展。期待该药后续临床试验顺利进行,早日造福患者。
[1]中国国家药监局药品审评中心(CDE)官网.Retrieved Mar 15,2022.From https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[2]产品速递 | 潜在first-in-class新进展,复宏汉霖创新抗PD-L1×TIGIT双抗在澳大利亚完成首例患者用药.Retrieved Feb 14,2022.From https://mp.weixin.qq.com/s/nBWdGbxMKPwbrkMfX5RjEw
本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发至朋友圈。转发授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。







 个人中心
个人中心
 我是园区
我是园区




