写意报告丨乙肝新药早期全球临床研发策略考虑
收藏
关键词:
研发
资讯来源:同写意 + 订阅账号
发布时间:
2022-01-08

应同写意邀请,Aligos Therapeutic高级医学总监吴旻在“首届中国(苏州)太湖医药创新大会”上做了《乙肝新药早期全球临床研发策略考虑》的报告,本文系根据报告内容整理,并经报告人确认。
本报告中创新药物,为创新机制的化合物尚未进入人体研究,或者是已有同类机制药物进入临床研究但尚未获得上市批准的药物。
目前,新机制抗乙肝病毒药物分为作用于病毒生命周期,即直接抗病毒的药物,另一类是作用于宿主,比如说免疫调节剂。
早期临床研究包括I期和II期,是指首次人体/首次患者I期研究和概念验证的II期临床研究。早期临床研究阶段的目的和监管要求,与后期以注册为目的的确认性临床研究侧重点不同:
第一,早期研究以临床前研究数据为依据,初步探索药物在人体/患者中的耐受性、安全性。据此,随后的注册临床研究在大规模的目标疾病人群中确认安全性;
第二,早期临床研究先在保守人群中了解PK特征以及PK/PD关系。继而,在进行后期研究的同时,平行进行不同人群的I期临床研究,比如儿童、老年人、肝肾功能不全的人,了解不同人群PK特征以及PK/PD关系;
第三,早期研究中通过短时间的给药,观察和药物机制相关的抗病毒活性指标改变。得到验证后,后期研究需要通过更长时间的治疗,确认药物导致的抗病毒作用和临床获益的关联;
第四,早期研究关注药物机制和疾病特征本身,法规要求、临床设计比较一致。而对于旨在上市的注册临床研究,各地区流行情况、发病率、临床常规诊疗的差异,药政部门对其会有不同的要求。
乙肝新药的临床研究设计,现阶段还需要健康受试者和病人两个部分,基本上都采用整合的I期临床研究设计,通过单次给药剂量爬坡、多次给药剂量爬坡在健康受试者当中获得的数据,进入到患者多次给药这样的阶段。
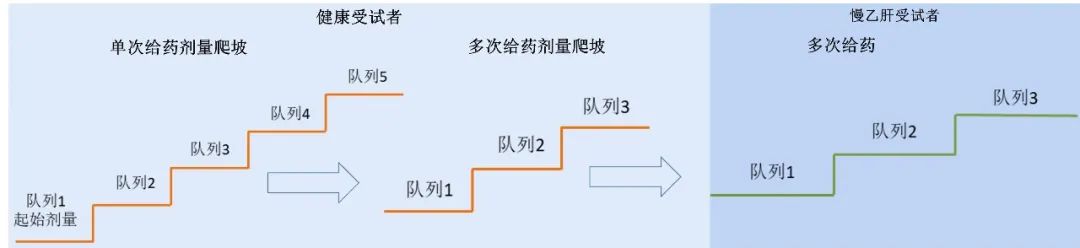
而对II期临床研究,大家公认的乙肝功能型治愈是需要不同机制药物的联合。问题是,现在临床前没有一个理想的模式,导致研究者必须进入临床后去探索不同机制的组合。
按照传统II期临床研究设计一个个去做,会非常低效,所以借鉴肿瘤的模式,平台研究设计、篮式研究设计、伞式研究设计被评估运用到乙肝临床研究中,最终目的是能够形成高效的概念验证研究,能快、准、狠地找出能达到治疗目标的适应症人群以及治疗方案进入确认性临床研究阶段。
我们可以依据给药方式、作用机制、药代特征以及临床前药学发现结果,去考虑是否在健康受试者人群当中需要有食物影响评估,是否需要健康受试者当中多次给药剂量爬坡,是否一定要有三个队列、四个队列,是否需要种族敏感性的评估?
在患者的部分,我们想强调的是研究设计要保留一定的灵活性。I期临床研究是基于前序队列的数据来决定后续队列研究的设计,因此一定要在方案设计时,考虑到在怎样的假设情况下,或者在安全性保证的情况下,去探索后续的不同人群或者不同治疗方案的评估。这非常重要。
例如,我们先基于一个保守的抗原阴性治疗的人群数据,再拓展到阳性人群,甚至拓展到初治或者目前没有治疗的人群中去。
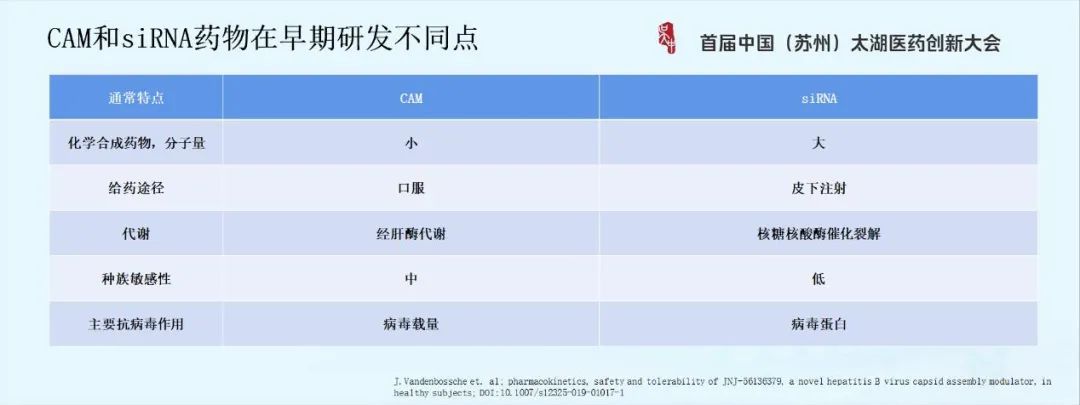
下面介绍两个类药物的临床研究设计,一类是CAM药物,另一类是siRNA药物。
CAM和siRNA作用机制虽然都是直接抗病毒,但它们作用病毒的复制阶段不一样,CAM主要是病毒载量的降低,而siRNA抑制病毒RNA的转录。这两类药物有以下不同点:
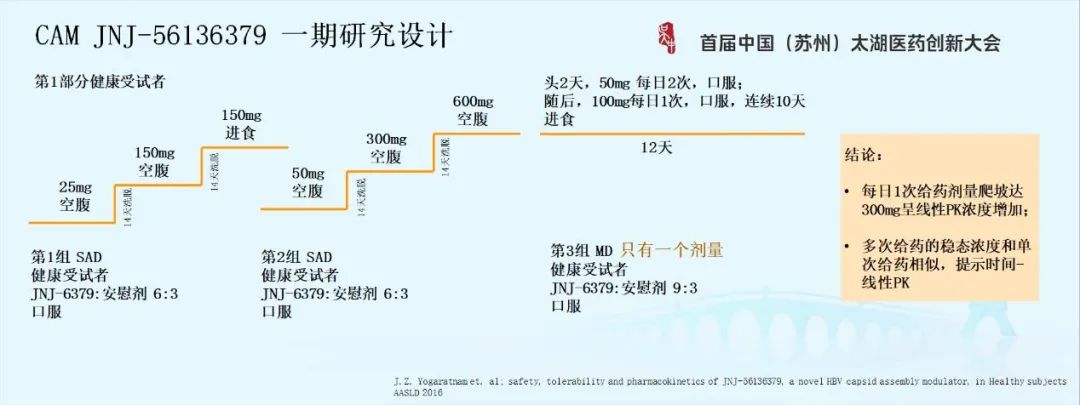
4.2 CAM JNJ-56136379 I期研究设计
基于以上不同点,我们首先来看强生JNJ-56136379 I期临床研究的设计。该设计分为两部分。
第一部分是健康受试者,单剂给药剂量爬坡当中在150毫克的时候进行食物影响评估,但多剂量方面没有做剂量爬坡,而是选择中间剂量做多次给药的评估,初步了解多次给药的PK,而在后期病人的那一部分去做多剂量的爬坡,观察PK、PD的关系选择合适的剂量,所以它没有像传统那么做。如下图:
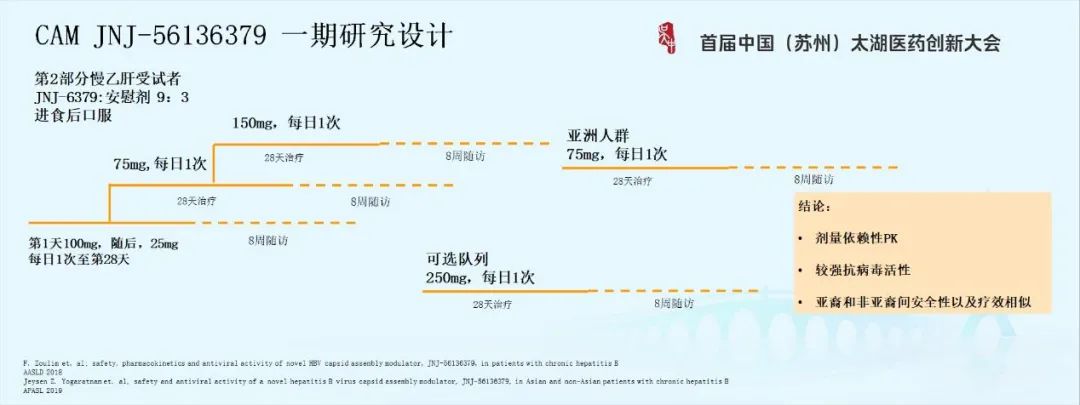
第二部分是慢乙肝受试者,做了三个剂量等级剂量爬坡的研究,但最初的设计有一个局限。当时这个研究在欧洲进行,考虑到该药为中度种族敏感性,为了在亚洲地区进行II期临床研究,因此中途加入一个亚种人群队列作为桥接。当剂量爬到150毫克,基于已获得的数据,研究设计的可选队列选择更高剂量水平250毫克进行评估。
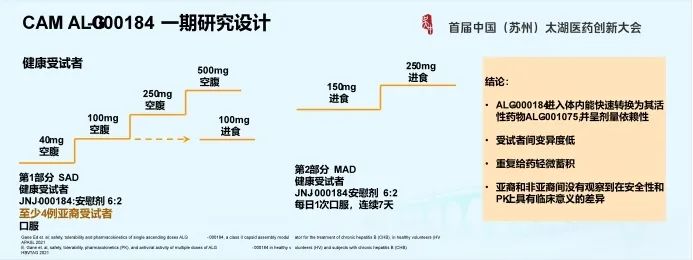
4.3 CAM ALG-000184 I期研究设计
根据CAM这类药物早期临床数据,ALG-000184的I期临床研究采用了优化设计。
譬如,在健康受视者单次给药的部分,每个队列纳入等比例的亚裔受试者,作为种族敏感性评估。
4.4 siRNA JNJ-3989 I/IIa期临床研究设计
首先,siRNA是皮下给药的药物,因此所有的siRNA药物当中是没有食物影响这部分。
其次,基于siRNA的作用机制和寡核苷酸类药物的代谢特点,在健康受试者当中,I期就做了单次给药剂量爬坡,之后直接进入慢乙肝患者进行多次给药的聘雇;
再次,它是低种族敏感性风险,所以在早期临床研究设计中,没有对不同种族人群的招募要求;
最后,慢乙肝患者部分的设计非常高效:1)采取的是一个开放的设计,没有任何对照;2)进行不同给药方案或者不同患者人群的评估,非常灵活;3)基于前序队列数据,最后还增加联合治疗方案的评估。

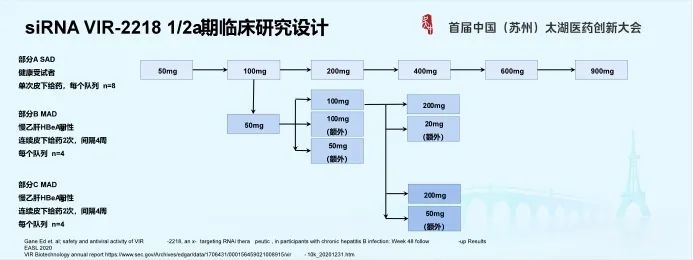
4.5 siRNA VIR-2218 I/IIa期临床研究设计
VIR-2218采用类似的I期临床研究设计,而下图更清楚地显示基于已获得前序队列数据,根据方案事先定义的程序,才能进行可灵活变动的后续评估。
早期临床研究策略优化需要综合性考虑,临床设计只是其中之一。其他譬如开展I期临床研究国家和地区,研究中心应对快速变化的I期临床的团队和流程,同步CMC研发计划以及最适合的II期研究设计。
第二,根据循证原则在早期研究方案设计中基于安全性风险可控的前体下保持灵活性;
第三,需要全球化视野制定早期临床研究策略,以快速进入人体或者患者的临床研究;
第四,协同合作加速创新乙肝联合治疗方案的研发,最理想的是一个公司有很多的药物能够做联合治疗的功能性治愈。在乙肝的领域,我们需要协同合作的方式,才有可能加快研发过程,得到有效的联合治疗方案,造福病人。
【首届中国(苏州)太湖医药创新大会】
相关报道文章推荐















 个人中心
个人中心
 我是园区
我是园区




