恒瑞「阿帕替尼」肝癌新适应症获批上市!CSCO 指南 I 级推荐
收藏
关键词:
上市适应症获批恒瑞癌
资讯来源:Insight数据库 + 订阅账号
所属行业:化学药制剂 + 订阅行业
发布时间:
2021-01-04
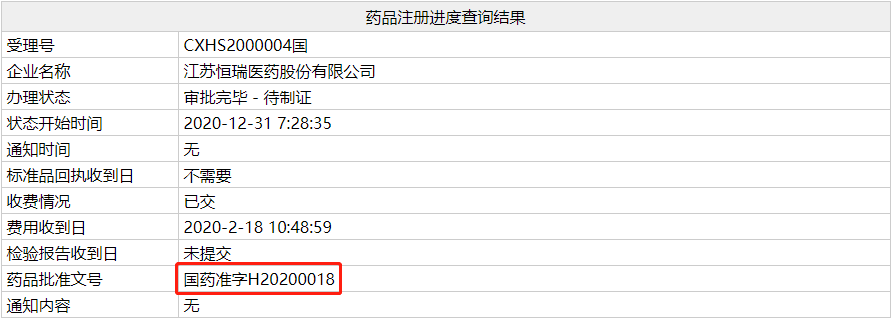
12 月 31 日,NMPA 官网显示,恒瑞「甲磺酸阿帕替尼」
肝癌适应症获批上市。此前,2020 最新版《中国临床肿瘤学会(CSCO)原发性肝癌诊疗指南》已基于阿帕替尼的优异临床结果将阿帕替尼单药正式纳入二线治疗推荐,推荐级别为 I 级,证据级别为 1A 类。
甲磺酸阿帕替尼是恒瑞自主研发的小分子靶向新药,于 2014 年获批上市,用于治疗既往至少接受过 2 种系统化疗后进展或复发的晚期胃腺癌或胃-食管结合部腺癌患者。
2020 年 2 月 14 日,恒瑞完成了阿帕替尼针对既往接受过至少一线系统性治疗后失败或不可耐受的晚期肝细胞癌(HCC)患者的 III 期临床,递交新适应症上市申请,即为本次即将获批的适应症。
该项上市申请是基于 III 期注册临床研究 AHELP 研究的结果,相关临床数据已在 2020 ASCO 年会中发布。AHELP 研究由南京金陵医院秦叔逵教授牵头组织、全国 31 家肿瘤中心联合开展,共纳入了 393 例既往接受过至少一线系统性治疗后失败或
不可耐受的晚期 HCC 患者。
结果显示,阿帕替尼能够显著延长患者的中位总生存期(mOS),达到 8.7 个月,而
安慰剂组为 6.8 个月;
中位无进展生存期(mPFS)为 4
.5 个月,也
明显高于对照组的 1.9 个月。
同时,阿帕替尼组的客观缓解率(ORR)达 10.7%,显著高于对照组的 1.5%。这表明
阿帕替尼治疗不仅具有较高的客观有效率,且获得明显的生存获益。
同时,阿帕替尼在晚期 HCC 患者中的耐受性良好,安全可控,且与既往阿帕替尼的临床研究和实践相比,未出现新的安全性问题。
基于 AHELP 研究的振奋性成果,在晚期 HCC 的二线治疗部分,《中国临床肿瘤学会(CSCO)原发性肝癌诊疗指南》2020 版将阿帕替尼单药正式纳入二线治疗推荐,推荐级别为 I 级,证据级别为 1A 类。
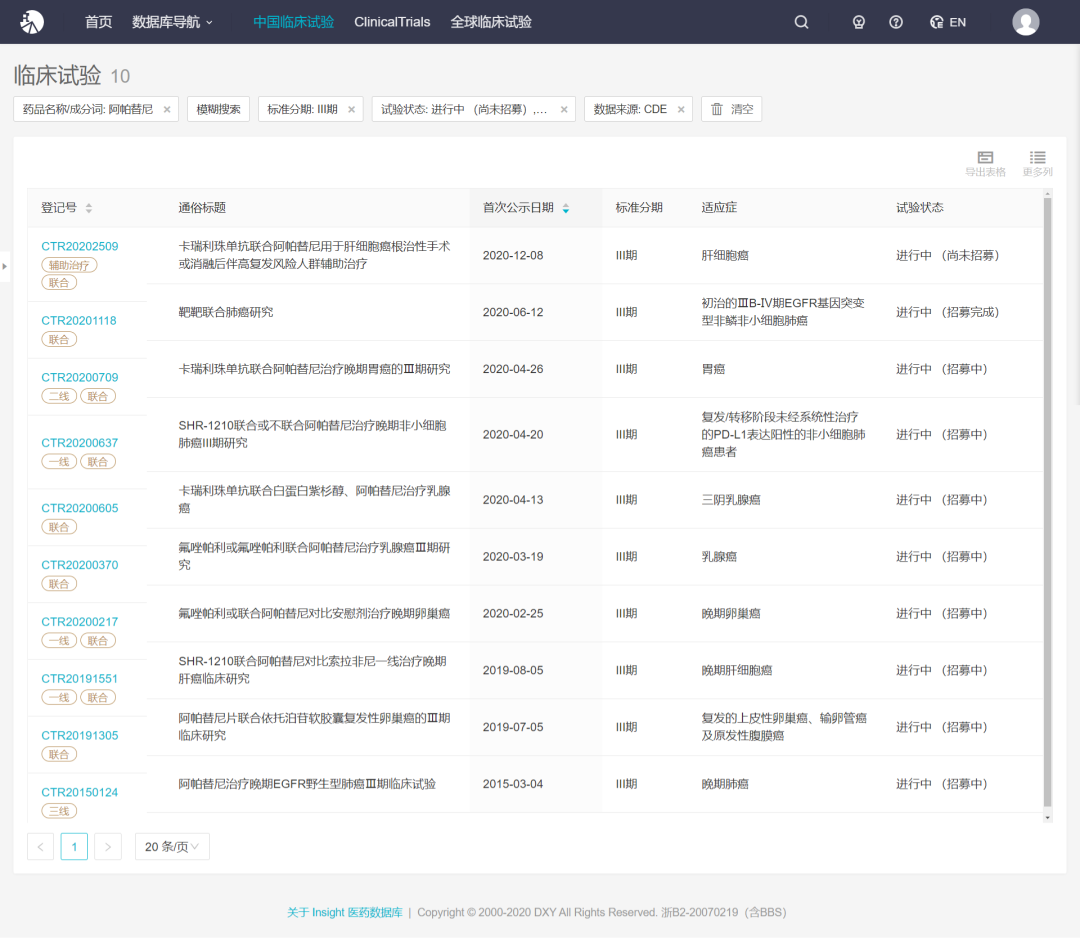
Insight 数据库显示,迄今恒瑞已针对阿帕替尼展开了 24 项临床试验,其中 19 项尚在进行中,10 项为 III 期临床,多为联合用药,主要是与 PD-1 单抗卡瑞利珠单抗联合用药。
来自 Insight 数据库(http://db.dxy.cn/v5/home/)
目前,阿帕替尼的同类产品中拜耳的索拉非尼、辉瑞的舒尼替尼、诺华的培唑帕尼已在国内获批上市。2019 年度,索拉非尼、舒尼替尼和培唑帕尼全球销售额约为 21.59 亿美元。
根据恒瑞披露的信息,2018 年甲磺酸阿帕替尼销售额约为 17 亿元人民币。在新适应症获批后,预计其市场将进一步打开,带动销售额再度上涨。
截至肝癌新适应症报上市,甲磺酸阿帕替尼项目已投入研发费用约为 33,234 万元人民币。
数据库合作
:微信联系 yiyaoshujuku001

 点击试用
Insight 数据库
,药圈最新情报轻松掌握
点击试用
Insight 数据库
,药圈最新情报轻松掌握


 点击试用
Insight 数据库
,药圈最新情报轻松掌握
点击试用
Insight 数据库
,药圈最新情报轻松掌握
 药选址
药选址



 点击试用
Insight 数据库
,药圈最新情报轻松掌握
点击试用
Insight 数据库
,药圈最新情报轻松掌握