▎药明康德内容团队编辑
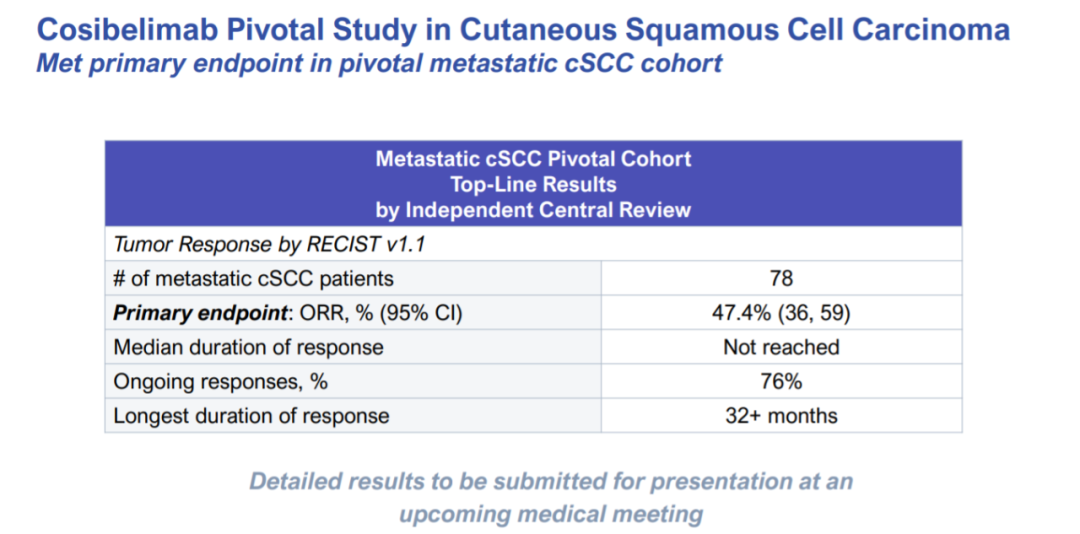
2022年1月25日,Checkpoint Therapeutics公司宣布,抗PD-L1抗体cosibelimab在一项支持注册的临床试验中获得积极结果。试验达到其主要终点,接受cosibelimab治疗的转移性皮肤鳞状细胞癌(cSCC)患者(n=78),达到47.4%(95% CI:36.0,59.1)的客观缓解率(ORR)。安全性和耐受性特征与既往研究一致。根据获得的积极数据,Checkpoint计划在今年年底向美国FDA递交生物制品许可申请(BLA)。

皮肤鳞状细胞癌是种常见的皮肤癌类型,虽然大多数病例是可进行根治性切除的局部肿瘤,依然是会有不少患者疾病进入晚期,危及生命。
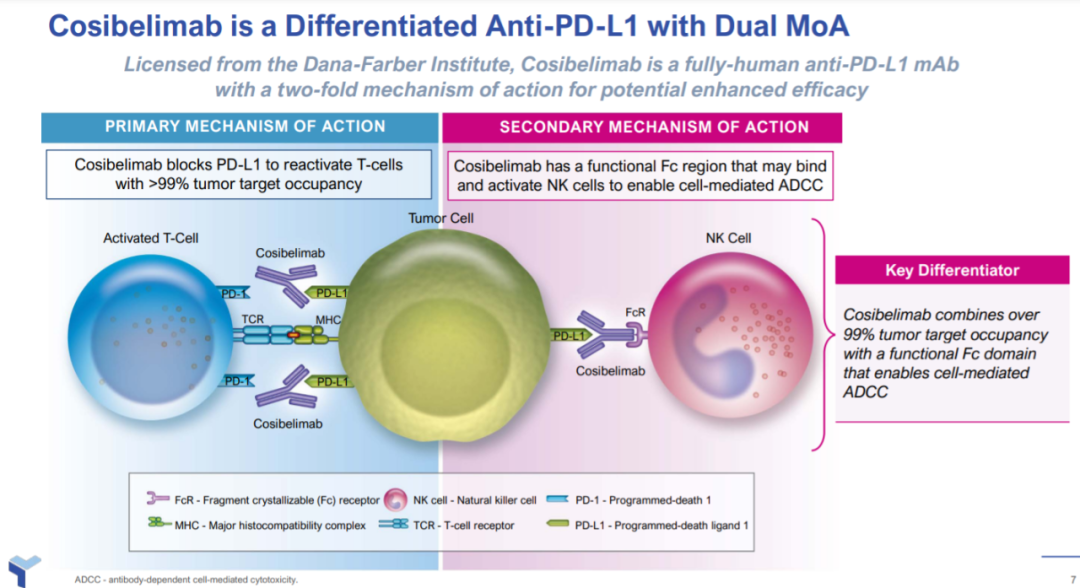
Cosibelimab(原名CK-301)是一款潜在“best-in-class”,高亲和力的IgG1亚型全人源抗PD-L1单克隆抗体。它通过直接结合PD-L1,阻断PD-L1与PD-1和B7.1受体的相互作用,从而消除PD-L1对抗肿瘤CD8阳性T细胞的抑制作用,恢复细胞毒性T细胞反应。Cosibelimab与目前获批的抗PD-1和PD-L1抗体的潜在区别在于,它可以与肿瘤细胞表面超过99%的PD-L1结合,重新激活抗肿瘤免疫应答。而且它具有能诱导抗体依赖性细胞介导的细胞毒性(ADCC)的功能性Fc结构域,可增强某些肿瘤类型的潜在疗效。
除了达到ORR的主要终点外,在数据截止时间,患者的中位缓解持续时间(DOR)尚未达到。所有队列中入组和接受治疗的201例晚期癌症患者表现出的安全性特征与既往研究一致,大多数治疗后出现的不良事件的严重程度报告为1级或2级。
图片来源: Checkpoint公司官网
Checkpoint总裁兼首席执行官James F. Oliviero先生表示:“我们很高兴报告在转移性皮肤鳞状细胞癌患者中进行的cosibelimab关键性临床试验的顶线结果。我们认为,较强的ORR结果可归因于cosibelimab具有差异性,利用T细胞和自然杀伤细胞的双重作用机制。同时还证明了其与PD-L1结合的潜在有利安全性特征,即与抗PD-1治疗相比,该药导致严重或较差不良事件的发生率较低。我们期待在即将召开的医学会议上详细介绍相关数据。”
参考资料:
[1] Checkpoint Therapeutics Announces Positive Topline Results from the Registration-Enabling Trial of Cosibelimab in Metastatic Cutaneous Squamous Cell Carcinoma. Retrieved January 25, 2022, from https://ir.checkpointtx.com/news-events/press-releases/detail/77/checkpoint-therapeutics-announces-positive-topline-results
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。









 个人中心
个人中心
 我是园区
我是园区




