Science:重大进展!揭示白内障形成的病理机制,有望开发出新的疗法
收藏
关键词:
重大进展揭示进展Science
资讯来源:生物谷 + 订阅账号
发布时间:
2021-12-19
随着年龄的增长,衰老在各种退化性疾病的发病中发挥着重要作用,包括白内障的缓慢发展。白内障是一种晶状体混浊,困扰着全世界数百万人的视力。形成眼球晶状体的透明细胞在一生中不断分裂,但在老年人中,这种细胞分裂过程的效率较低,而且衰老的细胞会引发透明度的下降。尽管发病机制在很大程度上还不清楚,但具有早发白内障
遗传
倾向的患者可以帮助确定分子机制。
缺乏脂质激酶PI3K-C2α会导致鱼类、小鼠和人类的白内障提前发生。这表明PI3K-C2α参与维持一种进化上保守的保护晶状体免受透明度下降影响的机制。在这一发现的基础上,来自意大利都灵大学等研究机构的研究人员在一项新的研究中,从该激酶参与有丝分裂以及正确的细胞分裂可避免衰老和白内障最终产生的概念出发,想要确定PI3K-C2α在晶状体中的作用。相关研究结果发表在2021年12月10日的Science期刊上,论文标题为“PI(3,4)P2-mediated cytokinetic abscission prevents early senescence and cataract formation”。
这些作者发现PI3K-C2α在细胞分裂的最后一步---细胞分裂脱落(cytokinetic abscission)---起着特殊的作用。在有丝分裂过程结束时,两个新生的子细胞形成一个收缩环,该收缩环使膜收缩并产生细胞间桥(intercellular bridge),最终一种特定的细胞器--中心颗粒体(midbody)--
协调的生化反应切割细胞间桥。PI3K-C2α被发现富集在中心颗粒体,在那里它产生一种特定的脂质分子,称为磷脂酰肌醇(3,4)双磷酸,缩写为[PI(3,4)P2]。PI(3,4)P2似乎是有效组装膜切割装置所必需的。这种膜切割装置是一种多蛋白聚合体,在其中,三个连续作用的、含有ESCRT蛋白的复合物串联在一起,最终切割了细胞间桥。
在中心颗粒体,ESCRT I(endosomal sorting complexes required for transport I)复合物触发了ESCRT II蛋白聚合体的去核,随后触发膜切割ESCRT III装置的去核。作为ESCRT II复合物中的一种关键成分,VPS36锚定在局部预形成的PI(3,4)P2上,从而适当地让ESCRT II蛋白聚合体在中心颗粒体上保持稳定。这是在鱼类、小鼠和人类中发现的,这表明这一过程在整个脊椎动物进化过程中一直是保守的。
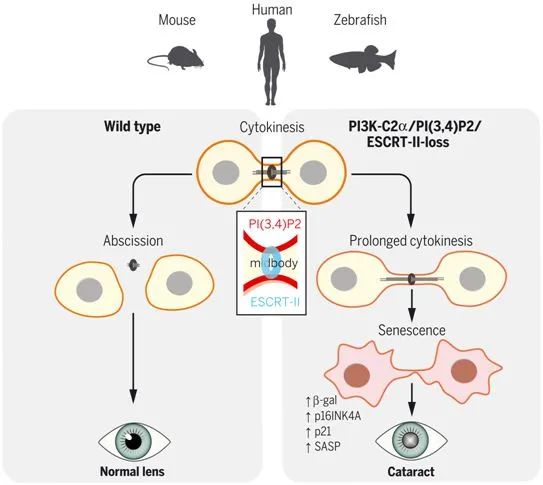
在细胞分裂过程中,PI3K-C2α在中心颗粒体中产生PI(3,4)P2(红色),触发对ESCRT-II亚基VPS36(浅蓝色)的招募。当PI3K-C2α、PI(3,4)P2或VPS36丢失时,在发生细胞分裂脱落的地方出现的中心颗粒体再次进入导致细胞分裂延长。这导致非整倍体和早期衰老,这在晶状体上皮中尤其明显,从而导致白内障。图片来自Science, 2021, doi: 10.1126/science.abk0410。
如果没有PI3K-C2α及其脂质产物PI(3,4)P2,ESCRT装置就会失去效率,细胞分裂就会延迟。延长的细胞分裂引发了p16INK4A的表达和转录程序的激活,从而导致衰老,这很可能避免了细胞分裂后再融合和四倍体化的基因组不稳定性。然而,细胞分裂演变为一种有弹性的细胞过程,在各种ESCRT复合体的组装中,冗余的途径很常见。例如,ESCRT III组装的另一种绕过了对ESCR II聚合体的需要的途径依赖于连接蛋白ALIX的功能。在晶状体中,ALIX表达不良,特别需要PI3K-C2α、PI(3,4)P2和VPS36途径来保护晶状体细胞免受细胞分裂延迟、衰老以及最终的白内障形成。
综上所述,这项新的研究提供证据表明基于定位在中心颗粒体的PI3K-C2α、PI(3,4)P2和VPS36的途径提高了细胞分裂的稳健性,在眼球晶状体中是不冗余的。这一过程出现故障是白内障产生的病理机制。基于此,这些作者最终确定了一条将ESCRT功能障碍和衰老相关联在一起的路径。
参考资料:
Federico Gulluni et al. PI(3,4)P2-mediated cytokinetic abscission prevents early senescence and cataract formation. Science, 2021, doi: 10.1126/science.abk0410.





 个人中心
个人中心
 我是园区
我是园区




