
责编 | 酶美
G蛋白偶联受体(GPCR),又称为七次跨膜受体,是目前已知的人类基因组中最大的膜蛋白家族。在人类基因组中,大约有800多个基因编码GPCR,负责80%左右的跨膜信号转导,参与调控人体中大多数病理与生理过程。目前临床上30%以上的处方类药物是靶向GPCR发挥作用的。GPCR主要通过G蛋白及arrestin将细胞外的刺激转变为细胞内信号。在这个过程中,G蛋白主要通过调节细胞内第二信使的水平来发挥作用;而arrestin则是通过招募不同的下游蛋白,使受体发生脱敏, 内吞和启动arrestin介导的信号转导途径。
然而,人类基因组只编码16个Gα蛋白亚型和4种arrestin,其种类远低于与它们相互作用的受体数量。因此,在调控受体功能和指导设计靶向GPCRs的治疗药物中,每个信号传感器如arrestin如何识别不同的受体刺激信号,并将其转化为下游效应的机制仍不清楚。
GPCRs招募arrestin之前通常会被GPCR激酶(GRKs)磷酸化,产生不同的磷酸化模式并通过与arrestin作用发挥不同功能。孙金鹏教授与王江云教授研究团队于2012年开始合作,针对受体与arrestin相互作用的磷酸化编码机制展开了一系列的研究工作,发现了GPCR磷酸化编码机制,创新性的提出了受体磷酸化的“笛子模型”理论(Nat Commun 6, 8202 (2015)。基于“笛子模型”的理论基础,该合作团队进一步揭示了GPCR 磷酸化编码别构调控SH3 domain 蛋白的多聚脯氨酸码头分选机制(Nat Chem Biol 14, 876-886 (2018))。然而,单个磷酸化位点是如何调控arrestin的构象及功能仍不清楚。本研究团队于晓、孙金鹏教授和北京大学金长文以及生物物理所王江云教授合作,应用晶体学,NMR和一系列功能实验,阐明了笛子模型中单个磷酸化位点结合对Arrestin构型和功能的贡献,在Nature Communications在线发表了题为“Structural studies of phosphorylation-dependent interactions between the V2R receptor and arrestin-2” 的研究论文。

本文中,本研究团队利用X-ray 晶体学解析了4种不同磷酸化模式的V2R C末端短肽(V2Rpp-1、-3、-4、-6-7)与arrestin的复合物结构,直接说明了不同磷酸化短肽与arrestin2形成不同的作用模式。工作中还意外发现了笛子模型中的新磷酸化编码方式,在arrestin上发现了新的磷酸根结合位点“V3’4’”。这一结果说明Arrestin与受体磷酸化编码的结合方式可能比想象中还复杂,存在磷酸化位点结合的优先次序,某些位置的磷酸化位点结合会决定其他位置是否可以结合,并可能还有未发现的新的磷酸化编码结合位点。(图一)。
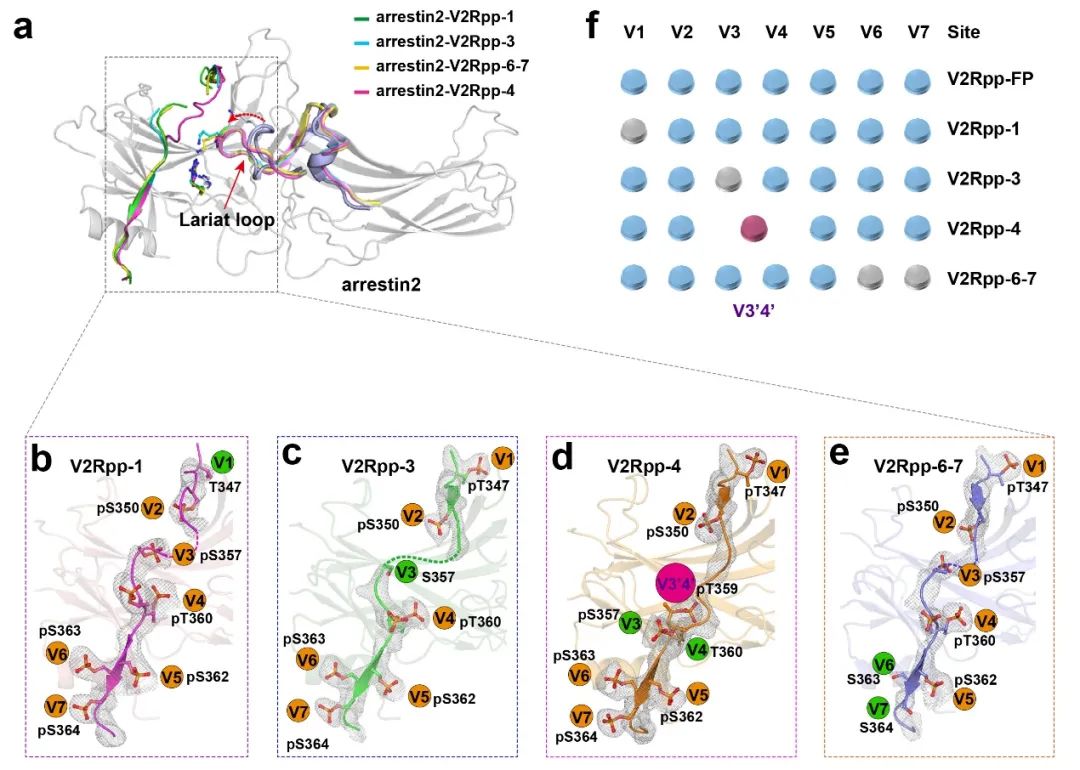
图一
与非激活态的arrestin结构比较发现,不同磷酸化模式短肽激活arrestin,均能引起arrestin远端功能结构域的亲水暴露面积(Exposure area)发生相应改变。同时,与V2Rpp-FP激活态arrestin结构相比,V2Rpp-1、-3、-4、-6-7激活态的arrestin在多处功能相关结构区域形成不同的结构构型。
为了进一步验证GPCR磷酸化对arrestin构型的调控作用,团队应用最近新发展的DeSiPher核磁共振检测技术(Nat Commun 11, 4857 (2020) ),通过基因密码子拓展技术在arrestin与MEK和c-Raf-1相互作用区域标记了一维氢谱核磁探针三甲基硅苯丙氨酸(TMSiPhe),能在低蛋白浓度、短时间内获取探针标记区域的动态构型变化信息。核磁检测结果说明,GPCR单个磷酸化位点缺陷可诱导arrestin与MEK和c-Raf-1相互作用区域产生特异的动态构象变化。以上结果说明GPCR单个的磷酸化位点缺陷可直接影响arrestin远端功能结构域的构型。
为了说明arrestin结构差异与功能相关性,该研究同时利用FlAsH-BRET实验检测了依赖V2R磷酸化的arrestin与MEK、c-Raf-1的相互作用。结果显示,V2R C末端不同磷酸化修饰位点突变引起的受体磷酸化模式差异可不同程度影响arrestin对MEK、c-Raf-1的招募能力(图二)。因此,GPCR磷酸化引起激活态arrestin的构型差异可引起arrestin不同的信号传导,调控arrestin发挥功能。
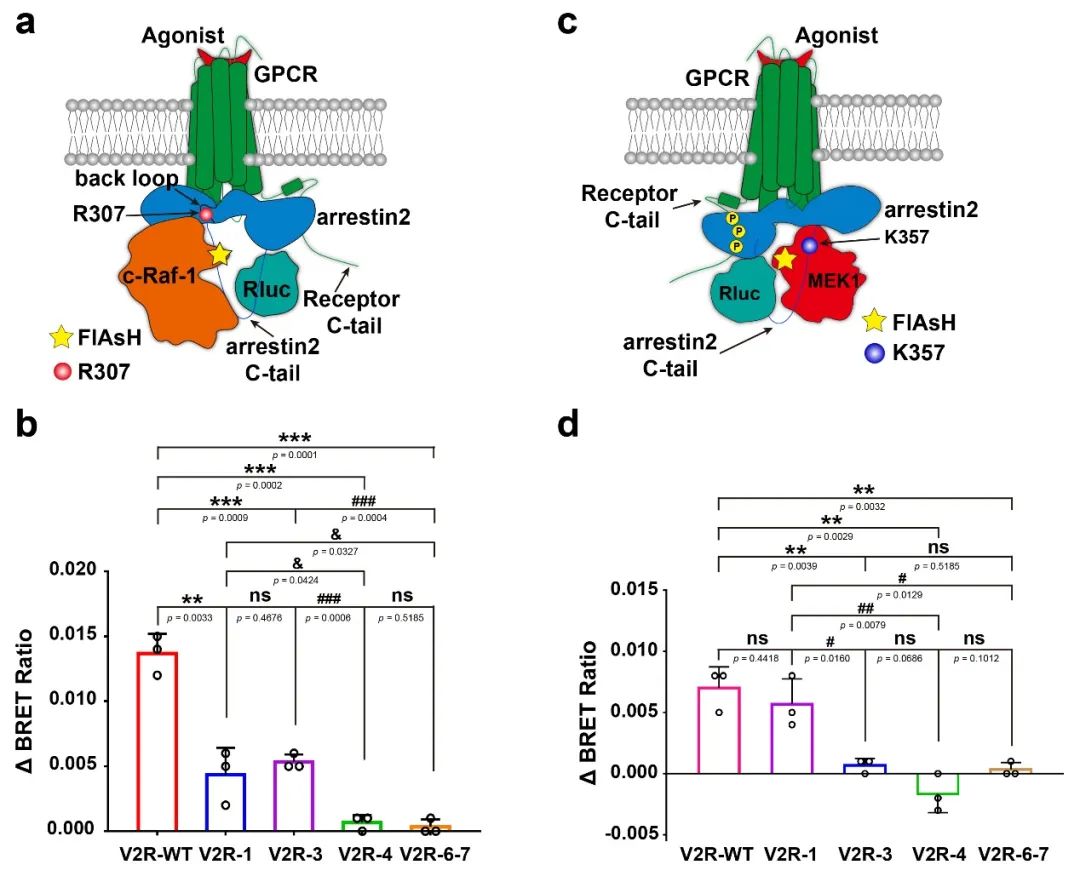
图二
综上所述,该项工作中,本研究团队解析了4种不同磷酸化模式的V2R C端短肽与arrestin的复合物晶体结构,结合DeSiPher和BRET 等技术手段,系统说明了GPCR单个磷酸化位点缺陷即可引起arrestin 远端功能结构域产生不同的构象变化,并发现了其与arrestin生物学功能的相关性,不仅揭示了GPCR单个磷酸化位点对arrestin功能的调控机制,还发现了磷酸化编码过程中重要的次序原理(图三),是2015年团队提出的磷酸化编码的笛子模型的进一步重要深度阐释和拓展,并在机制方面有了更深入的探讨。
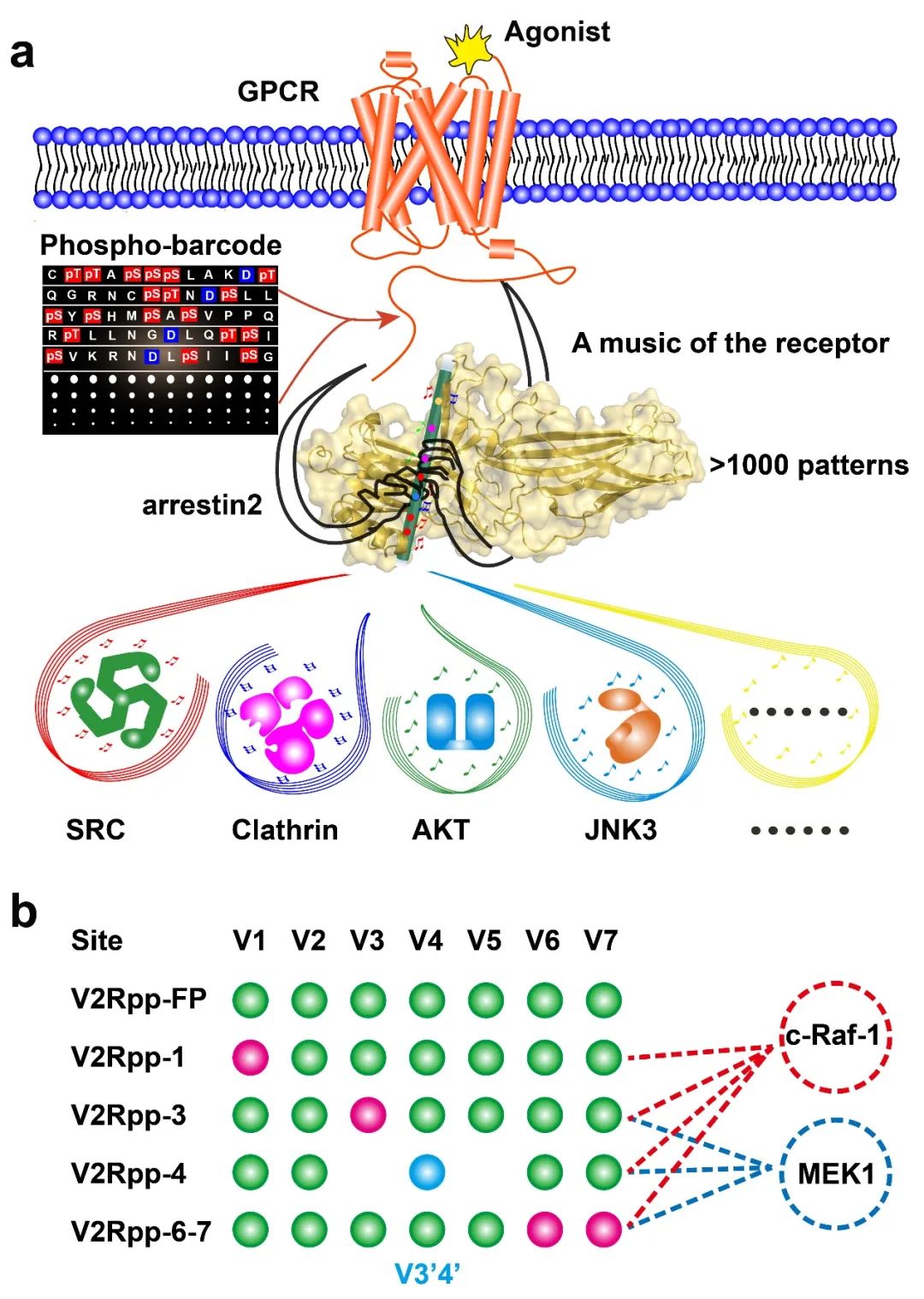
图三
山东大学基础医学院博士贺庆涛、林婧宇和肖鹏研究员,北京大学医学部博士黄深明、教工贾英丽,中国科学技术大学生命科学学院朱中良老师为本篇论文的共同第一作者;山东大学基础医学院于晓教授和孙金鹏教授,北京大学化学与分子工程学院金长文教授和中科院生物物理研究所王江云研究员为共同通讯作者。
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




