
图片来自theedgemarkets.com
导读
很多人可能不了解中外制药这家公司,了解这家药企的人可能也是因为它们的双抗技术。实际上,它是一家日本公司,已有近百年的历史,其成立之初只是一家生产非处方药的化药公司。
中外制药由原中外制药(Chugai)和日本罗氏制药(Nippon Roche)合并而成,这两家公司分别于1925年和1932年在日本成立,它们通过建立研究实验室和工厂,实现了企业管理的现代化。
接下来,我们将梳理自中外制药成立以来,它是如何披荆斩棘、克服困难、提升创新能力的。实际上,它的成功不仅在于它在医药领域的百年坚持,与时俱进也很关键,如它与设立在日本的国外公司(日本罗氏公司)合并、在双抗领域发力,也是助力其高速发展、在国际上立足的关键。
文 | 初心、陈博文
责编 | 叶水送

中外制药最初的原型其实是两家公司,其一是日本企业家上野久三(Juzo Ueno)于1925年创立的Chugai Shinyaku Shokai,当时他目睹关东大地震造成的破坏后,上野以“创造对世界有用的药物”为使命,成立了一家医药贸易公司。
另一家公司是日本罗氏制药,由瑞士罗氏制药公司于1932年创立。罗氏制药于1904年开始向日本出口产品,从成立之初就致力于为日本市场的未来奠定基础。
这两家公司于2002年合并,形成了今天的中外制药,它始终以创造创新医疗产品和服务,为世界各地的医学界和人类健康谋福利。

中外制药的由来

医疗代表先驱二宫正平,图片来源:chugai-pharm.co.jp
瑞士罗氏制药的产品于1904年首次进入日本,面对贸易公司代销的惨淡销售业绩,罗氏决定开始直接销售,并派遣外科医生鲁道夫·艾柏林(Rudolf Ebeling)前往日本。
艾柏林医生聘请了接受过医学培训,能说流利德语的药剂师二宫正平(Shohei Ninomiya),自此,二宫先生成为了当时医疗代表(MRs)的先驱。

战后动荡期

在重建的过程中,公司也面临着市场对Salsobrocanon和其他产品需求下降的危机。此时,葡萄糖醛酸内酯(Guronsan)和Varsan Tablet这两款新产品将该公司从悬崖边拉了回来。
1951年,业务低迷的中外制药在工业合成葡萄糖醛酸方面取得了成功。它作为一种具有解毒、改善肝功能的药物,因具有世界领先水平的研究成果而备受关注,目前出口到以欧洲为主的31个国家。第一个财年的产值约700万日元,1955年增长到10亿日元以上,为中外合资的发展作出了重要贡献。
1952年,中外制药开发并推出了日本第一种家用杀虫剂。最初的产品Varsan Tablet是一种药片,放在一个锡勺里,随着蜡烛的热量蒸发进行杀虫。不久之后,灯泡取代了蜡烛,指环取代了勺子,产品名称变成了Varsan芳香剂——一种杀虫熏蒸剂。这种杀虫剂很快从家用扩大到办公大楼、工厂和林业业务等领域。
日本罗氏制药公司这边,从1933年全面合成维生素C开始,罗氏制药在瑞士巴塞尔的总部成功地合成了多种维生素,并最终能够供应所有13种维生素,赢得了“维生素王”的绰号。
20世纪60年代,日本罗氏制药成为日本家畜饲料市场的先驱。它的业务扩展到食品、牲畜饲料以及制药领域。

中外制药的艰难转型
1961年,日本建立了全民健康保险制度,导致处方药需求迅速增长。随着对非处方药越来越多的批评,中外制药决定从非处方药转向处方药。在公司全体成员加强管理结构和提高研发水平的努力下,1974年公司50%的销售额来自处方药,30%来自非处方药,20%来自其他来源。

以处方药为重点的战略为未来播下种子,图片来源:chugai-pharm.co.jp
20世纪60年代中期,中外制药因其非处方药而备受批评,导致其销量暴跌,股价跌破面值。上野公生(Kimio Uyeno)于1973年接任社长一职。在第二年的新年贺词中,他发表了重建公司的经营目标,并提出了“追求经济效益、追求社会意识、追求人类的发展”的“公司三大原则”,并很快成为公司的行为准则。
20世纪60年代后期,中外制药的研究方向发生了重大转变,从非处方药转向处方药,将免疫学作为一个新的研究领域。从1965年开始,公司全力研究开发了抗肿瘤药物溶链菌制剂(Picibanil),并于1975年推出了该产品。溶链菌制剂的成功开发,使中外制药在免疫学领域名声大扬。
20世纪70年代对中外制药来说是其研究活动转型的时期。从以技术为导向的基础和应用研究转向内部开发原始新药。上世纪80年代推出了新药包括改善钙骨代谢的药物阿法骨化醇(Alfarol)、第三代头孢菌素类抗生素噻孢霉素(Cefotax)和治疗心绞痛的药物尼可地尔片(Sigmart)。1984年,中外制药首次实现了1000亿日元的净销售额,但这颗增长的种子是在20世纪70年代播下的。
这期间,日本罗氏制药也快速发展,员工人数从1965年的120人增加到1972年的近1000人。

从化学药向生物药转变
在20世纪80年代上半叶,中外制药的政策发生了转变,从化合物研发转为将生物技术应用于药品研发中。在这一转变之后,它最初的成果是1990年的依泊汀(Epogin)和1991年的来格司亭(Neutrogin)。这一经验促进了后来治疗性抗体的研究,但如果没有20世纪80年代向生物制药方向的转变,中外制药可能不会是今天的样子。

工厂里的员工,图片来源:chugai-pharm.co.jp
在日本缺乏生产生物制药的技术和工艺的情况下,中外制药于1983年向美国风险企业遗传学研究所(US Venture Genetics Institute Inc)投资,并开始了促红细胞生成素(EPO)配方的联合研究,这一决定导致了5年半后“Epogin”的诞生。在如此短的时间内成功开发出这款产品,证明了中外制药的技术和组织实力。
来格司亭的开发始于1974年,由中外制药与国内大学、专业机构在一个产学研框架下进行开发。1984年,中外制药率先成功纯化出重组人粒细胞集落刺激因子(G-CSF),建立了利用基因工程进行大规模生产的技术。1987年,中外制药开始临床试验,四年后推出了第二款生物制药产品来格司亭。虽然从研发到上市花了17年时间,但该产品标志着落后于欧洲和北美的日本生物制药发展进入了一个新阶段。
前社长上野在1973年新年贺词中提出的“企业三原则”也随着时代的变化而变化。1993年,当时的总裁长山修(Osamu Nagayama)强调了全球化的重要性,并提出了“追求国际化”的原则,从而确立了企业的四项原则。随着这一新的理念和中外制药二十一世纪愿景的宣布,公司的目标正式确定为成为一个有价值的创造者、一个全球性的公司,造福世界各地的医学界和人类健康。

与罗氏制药结盟
1975年,罗氏制药在美国新泽西州Nutley实验室合成了一种具有抗癌活性的化合物,但人们认为它很难在注射上取得商业成功。考虑到这一点,日本罗氏研究中心开始开发一种口服制剂。1987年9月,日本罗氏公司推出口服抗癌药物氟铁龙,两年半后年销售额达到100亿日元。
为了加强创新能力,让全球的患者受益,中外制药于2002年与世界领先的制药公司之一罗氏建立了战略联盟。这一联盟产生了一种独特的商业模式——中外制药能够将国外已经批准的罗氏产品授权使用,并利用罗氏的前沿专业知识和基础设施扩大自己的价值贡献。此后,中外制药通过重组业务运营、研究实验室和工厂,改变了公司的收入结构。
2001年12月,中外制药与罗氏制药结成战略联盟。次年,也就是2002年10月,罗氏获得了中外制药的多数股权,使其成为罗氏集团的一员。不过,与并购活动中常见的情况一样,中外制药的名称并未发生变化,双方同意中外制药继续上市,并保持管理层的独立性。因此,中外制药不仅能够利用罗氏在销售和开发方面的协同效应,而且能够自主进行商业决策。
随着罗氏抗癌药物的加入,中外制药自2008年以来一直保持着日本肿瘤领域的第一份额。中外制药提供创新的药物和服务,旨在实现癌症治疗,让患者带着希望面对疾病。
中外制药与罗氏的联盟进一步稳定了收入基础,使中外制药能够在日本独家销售罗氏产品,并通过罗氏的网络扩展自己的产品。这也对研究和开发产生了积极影响,具体体现在中外制药世界级的抗体工程技术和中型分子药物发现技术。

抗体工程技术的发展
中外制药的创新药物发现是基于其独特的抗体工程技术。在抗体药领域,中外制药从成立到现在一直在不断创新,从20世纪90年代的人源化抗体到2005年ADCC和ADCP增强型抗体到2008年的双特异抗体,循环抗体和清除抗体再到2012年Switch antibody直至现在的第三代双特异抗体,其每一次的创新都在解决抗体药领域中不同的难题。
目前,其发明的抗体相关技术平台已经几乎包含了抗体的方方面面,这些技术包括Recycling antibody、Sweeping antibody、TwoB-Ig、pI-FcTM、Switch Antibody、ART-Ig、FAST-Ig、ART-Fc、ACT-Fc和ACT-Ig,Dual-Ig,Dual/LINC-IgTM,LINC-IgTM,PAC-IgTM,MALEXATM
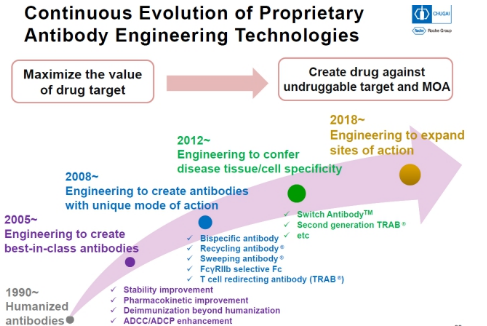
中外制药抗体技术的发展轨迹
6.1 Recycling antibody®
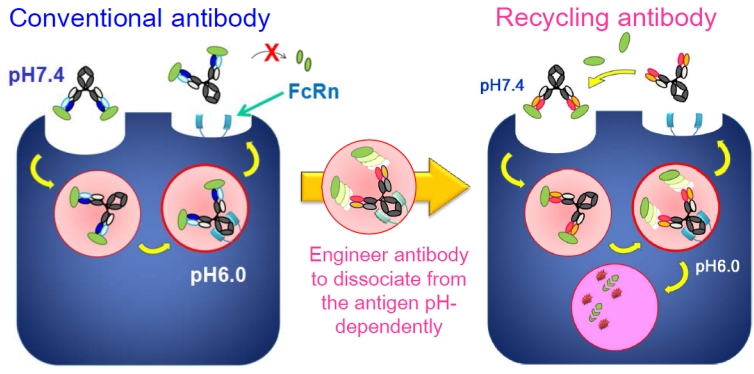
在生物体内,抗体对抗原的清除主要是抗体结合抗原后,抗体抗原的复合物被细胞内吞后进入细胞,在细胞内,抗体抗原复合物被溶酶体降解,或者与FcRn结合后被带到细胞表面被释放到细胞外,因此,抗体对抗原的结合是一次性的。
而Recycling antibody是对抗体的可变区进行改造(主要是通过将抗体的CDR区的部分氨基酸替换为组氨酸),使抗体在PH7.4(中性环境)中结合抗原,而在PH6.0(溶酶体的酸性环境)中释放抗原。当Recycling antibody抗体抗原复合物进入细胞溶酶体中后通过溶酶体降解或者释放后的抗原被溶酶体降解,而抗体通过FcRn再循环到细胞外,在细胞外,抗体可以再次结合抗原,因此可以多次重复利用,降低抗体相关药物的用量。
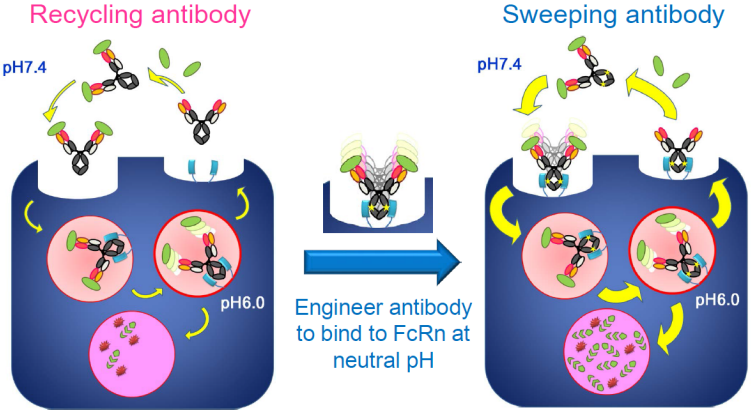
6.2 Sweeping antibody®
第一代的Sweeping antibody是对Recycling antibody平台的进一步改造,改造后的抗体在中性条件下可以结合细胞膜表面的FcRn,这样,抗体在结合抗原后可以很快的与细胞表面的FcRn结合被胞吞进入细胞,随后进入溶酶体降解,或者通过FcRn再循环回到细胞外。在生理条件下,抗体抗体被胞吞进入细胞速率较低,因此该机制可以加快抗体进入细胞,因此可以加快抗体对抗原的清除。
6.3 第二代Sweeping antibody
第一代的Sweeping antibody抗体在小鼠体内可以将抗原的清除能力提高约50倍,但是在猴子体内,其效果较差。为了能够使Sweeping antibody抗体在人体内发挥作用,中外制药引入了TwoB-Ig®和pI-FcTM技术。
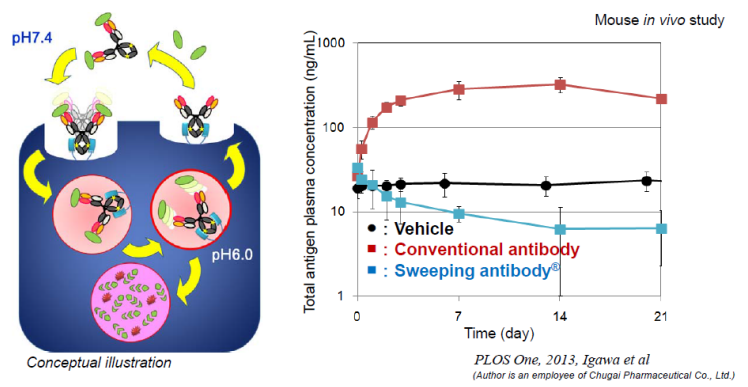
第一代Sweeping antibody在小鼠体内的效果
TwoB-Ig®是对抗体的Fc进行改造,使抗体与FcγRIIb的亲合力增加。FcγRIIb在肝窦内皮细胞清除抗体抗原复合物中发挥主要作用,因此增加FcγRIIb对抗体的亲和力可以加速抗体抗原复合物的清除。
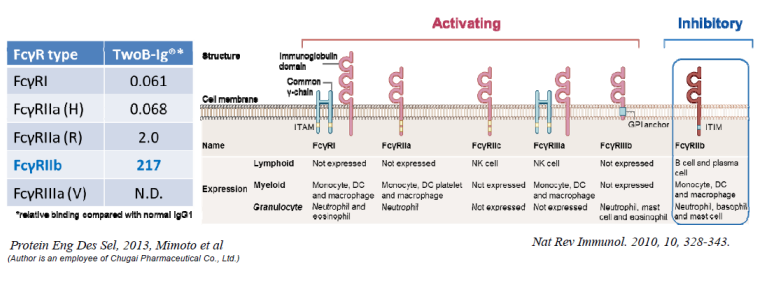
6.4 pI-FcTM
pI-FcTM是利用细胞膜带负电的特性,对抗体的Fc改造,使其表面带更多的正电荷,当抗体与细胞膜接近时,通过抗体Fc的正电荷与细胞膜表面的负电荷的相互作用促进细胞对抗体抗原复合物的内吞。
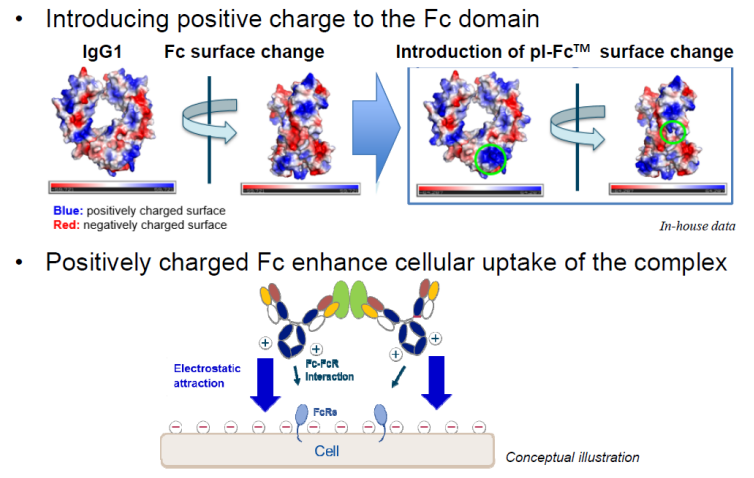
pI-FcTM作用机制示意图
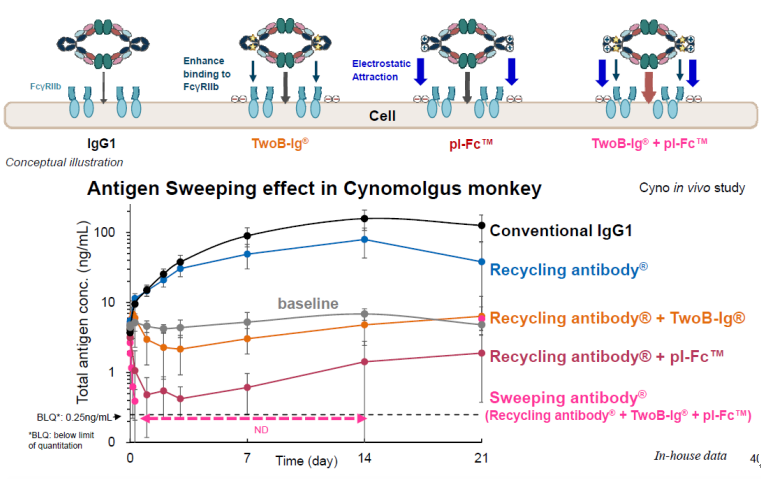
新一代weeping antibody在猴子体内对抗原的清除
6.5 Switch Antibody
Switch Antibody的开发主要是为了解决免疫治疗中的On-target毒性问题,对于激活机体免疫系统的抗体,如CTLA-4和4-1BB等抗体,其可以系统性的激活机体的免疫系统,从而导致过度的免疫反应;另外,靶向实体瘤的多种靶点在正常的细胞表面也会有表达,因此抗体可以无差别地结合肿瘤细胞上的靶点和正常细胞上的靶点,从而造成副反应。
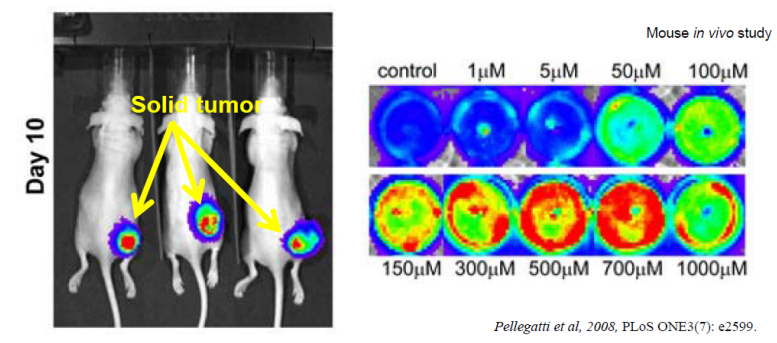
而Switch Antibody利用某些小分子如ATP等在肿瘤微环境富集的特点,以小分子为媒介激活抗体,从而使抗体仅在肿瘤中特异性激活。
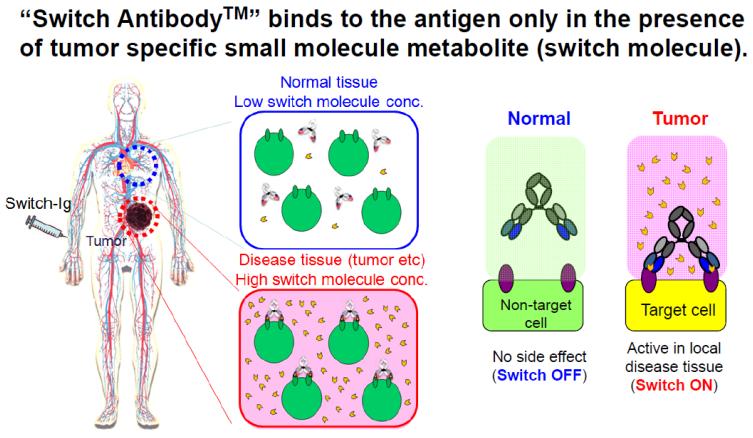
中外制药选择的小分子为ATP,因为ATP在正在细胞内的浓度在5-8mM,在正常细胞外浓度约为30nM。但是在肿瘤微环境中,ATP会从坏死,凋亡等肿瘤细胞中释放,因此其浓度较高,有研究表明,在小鼠实体瘤中,其细胞外ATP浓度高于100uM。
6.6 ART-Fc(Asymmetric Re-engineering Technology-Fc)
ART-Fc是对抗体的两个Fc进行非对称的改造,以此来增强抗体Fc与FcγRIIIA的亲合力,从而增强抗体的ADCC效应。该方法比传统的去除岩藻糖增强ADCC的效果更好。
6.7 ACT-Fc
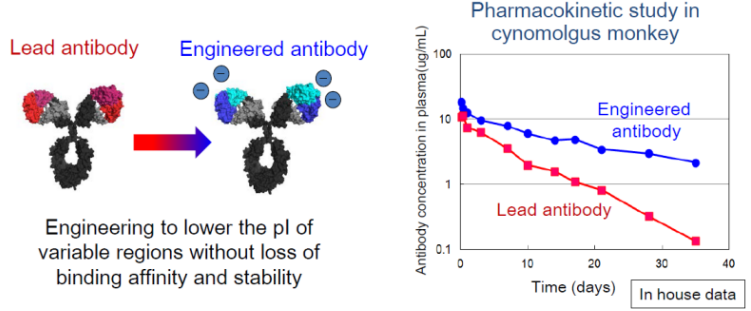
ACT-Fc是通过对抗体的Fc改造,从而增强抗体与FcRn的结合能力,进而增加抗体的半衰期。传统抗体的半衰期在3周左右,改造后的抗体在Emicizumab上半衰期可以增加到50多天,这样理论上可以大大降低给药的频率。
 ACT-Fc增加抗体的半衰期
ACT-Fc增加抗体的半衰期
6.9 ART-Ig(第一代双抗)
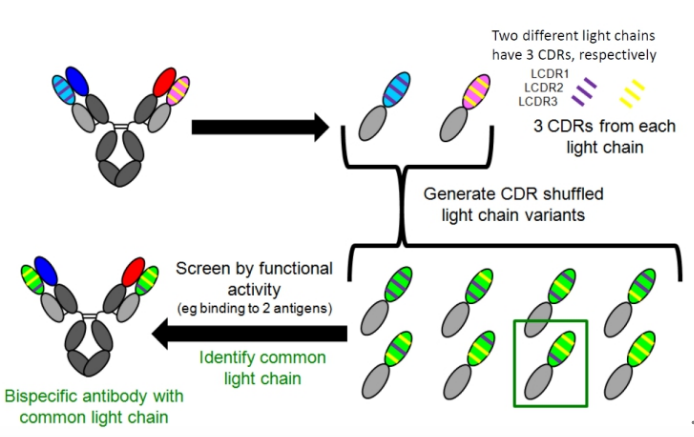
ART-Ig为不对称1+1型的双特异抗体,为了防止两个结合不同抗原的Fab的轻链错配,其采用了共同轻链的策略。共同的轻链的筛选方法如下图:首先筛选能够结合不同抗原的两个抗体,分别得到两个不同的轻链(每个轻链包含三个不同的CDR区),然后将两个不同抗体抗的CDR区进行组合,并利用体外实验对不同的组合进行评价,最终得到能够和两个不同重链互补配对且有生物学功能的轻链。
为了防止抗体重链的错配,ART-Ig平台中对两个抗体的Fc进行氨基酸突变,在其中一个抗的Fc端引入正电荷突变,在另外一个抗体的Fc端引入负电荷氨基酸突变。最终利用正负电荷相互吸引的特点促进两个不同的抗体正确配对,经过改造后,异源二聚体的比例高达99%。
虽然通过共同轻链和Fc引入正负电荷可以在很大程度上降低双特异抗体的错配,但是在生产中,错配问题不可避免,为了在下游纯化中除去错配的双特异抗体,ART-Ig对双特异抗体的两个抗体Fab的可变区进行氨基酸突变,使两个Fab有不同的等电点。改造后正确配对的双特异抗体和错误配对的双特异抗体有不同的PI,因此在下游纯化中可以利用离子交换色谱柱除去错位配对的抗体。
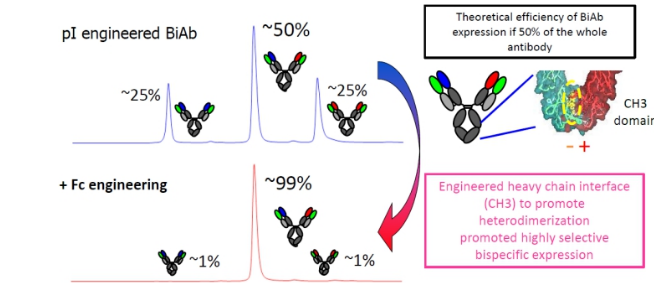
ART-Ig PI改造通过纯化除去错配抗体
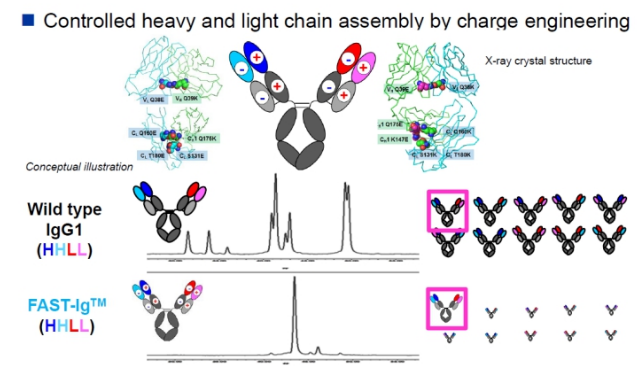
6.11 Dual-Ig 技术平台(第三代双抗)
Dual-Ig(Dual effectpr/receptor redirecting-Immunoglobulin)是中外制药开发的新一代双特异(或者是三特异抗体)平台,该平台旨在解决T细胞浸润较少的实体瘤治疗效果差的难题。研究中,实体瘤总体上分为三类:1)T细胞充分浸润的肿瘤(inflamed);2)T细胞少量浸润的肿瘤,该类型中T细胞主要集中在肿瘤的外周(immune excluded);3)T细胞几乎没有浸润的中瘤(immune desert)。当然也有人分为两类:“热肿瘤”和“冷肿瘤”。
目前通过CD3激活T细胞的双特异抗体(T cell Redirecting AntiBody:TRABTM)已经在血液瘤中展现了良好的疗效,而且目前临床中也多数正在探究用于实体瘤的治疗。但是因为实体瘤的高度的异质性以及T细胞浸润问题,因此不是所有的病人对双抗的治疗都有响应。
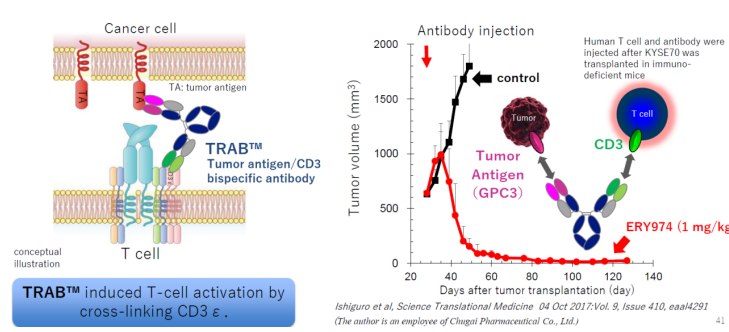
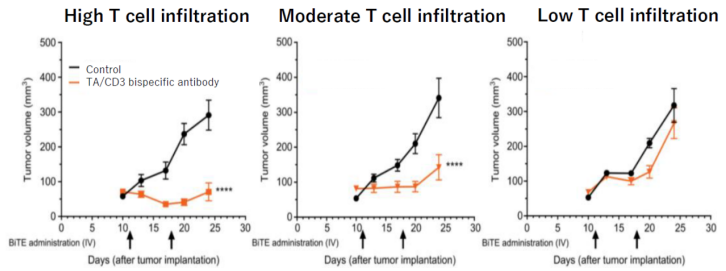
研究表明,这类双特异抗体在T细胞浸润较高的肿瘤(热肿瘤)中一半具有较好的响应,并且可能具有较好的疗效,而随着T细胞浸润的下降,抗体的治疗的效效果也会大幅度降低。在体外,其对肿瘤细胞的杀伤效率也大幅度降低(下图)
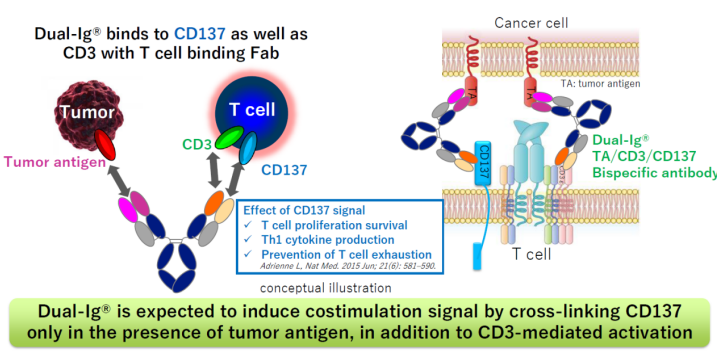
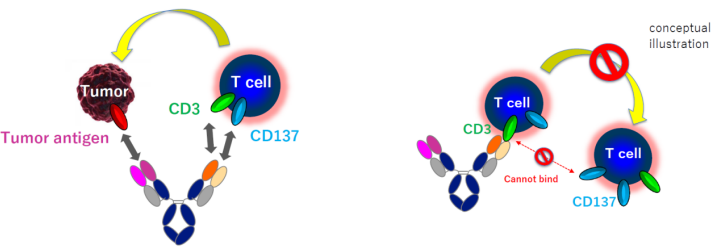
Dual-Ig的设计如下图所示(下图),其对双特异抗体中结合CD3的Fab进行改造,使其不仅能够结合CD3的也可以结合CD137(4-1BB),但是该Fab对两个靶点结合不是同时结合,其一次只能结合CD3或者CD137,该设计是为了防止T细胞之间的自相残杀(下图),因为如果该Fab可以同时结合CD3或者CD137,那么其结合的CD3或者CD137不是位于同一个T细胞上,就是位于两个不同的T细胞上,当为后者时,两个T细胞就有可能进行相互杀伤,从而损害药效。
之所以选择CD137,这是因为CD137是T细胞的共刺激因子,其在T细胞的增值和存活中具有重要的作用。因此该抗体在利用CD3激活T细胞的同时可以防止耗竭。另外,其可以促进T细胞产生Th1相关细胞因,这些因子在肿瘤的杀伤中同样发挥作用。因此总的来讲,该技术不仅可以强力的激活T细胞而且能长时间维持其活性。
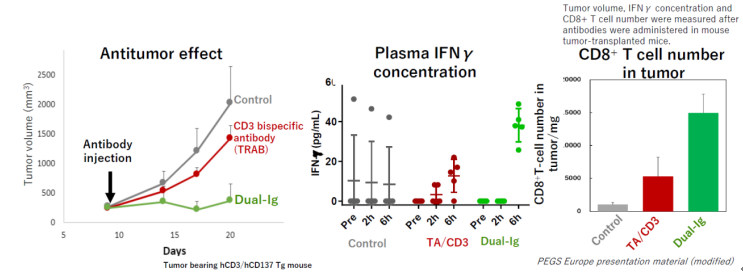
在较少T细胞浸润的模型中,传统的双抗(TRAB)仅有微弱的抑制肿瘤生长的效果,而Dual-Ig可以很好的抑制肿瘤的生长;另外在肿瘤中CD8T细胞数量方面,传统的双抗治疗后,肿瘤中(每100万个肿瘤细胞中)约有5000个T细胞,而Dual-Ig与传统双抗相比可以将肿瘤中的T细胞数量提升到15000左右,这也是为什么Dual-Ig的治疗更有效。
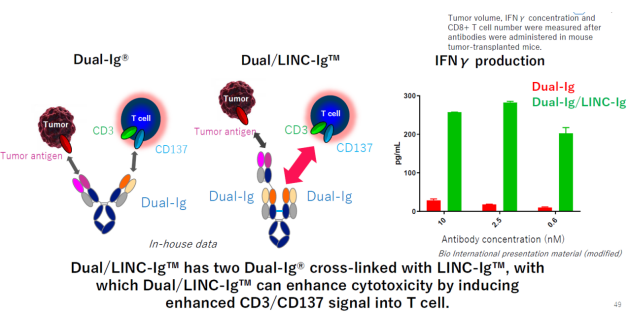
6.12 Dual/LINC-IgTM
Dual/LINC-IgTM是对Dual-Ig抗体平台的进一步改造,与Dual-Ig相比,Dual/LINC-IgTM含有两个可以结合CD3/CD137的Fab,并且这两个Fab通过二硫键固定即LINC-Ig技术(下一个平台介绍),因此其可以进一步增强抗体对T细胞的激活,在体外实验中,Dual/LINC-IgTM用药后IFN-γ的释放量是Dual-Ig的10倍以上。
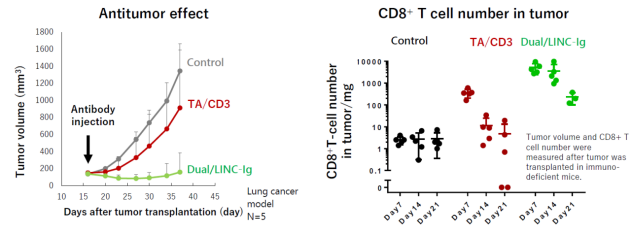
在小鼠肿瘤模型中,常规的双特异抗体对几乎没有T细胞浸润的肿瘤基本无效;在促进T细胞浸润方面,常规的双抗仅能有限的促进T细胞进入肿瘤。而Dual/LINC-IgTM双特异抗体平台,无论是在治疗效果还是在促进T细胞浸润方面都优于常规双抗和第一代的Dual-Ig抗体。
在Dual-Ig抗体平台应用方面,目前中外制药已经有多个项目处于开发中,其中不仅包括Dual-Ig或者Dual/LINC-IgTM单独用药,还包括与常规双抗(TRAB),Switch-IgTM联用甚至是三种抗体的联合使用。

6.13 LINC-IgTM
LINC-IgTM(LINCed-Immunoglobulin)是在抗体两条重链CH1中引入二硫键,从而将抗体的两个Fab固定,该设计主要是为了增强激动型抗体的效果设计。传统的抗体为Y字型结构,因为铰链区的存在,两个Fab相对比较灵活,因此其可以自由的结合抗原。而对于激动型抗体,抗体的发挥作用需要将供体或者受体二聚化或者多聚化,因此抗体相对灵活的结构反而在一定程度上阻碍了受体的二聚化或者多聚化。
在体外药效实验中,LINC-IgTM与传统的单抗激动剂相比,可以更加有效的促进受体的二聚化或者多聚化,并有效的激起免疫反应。

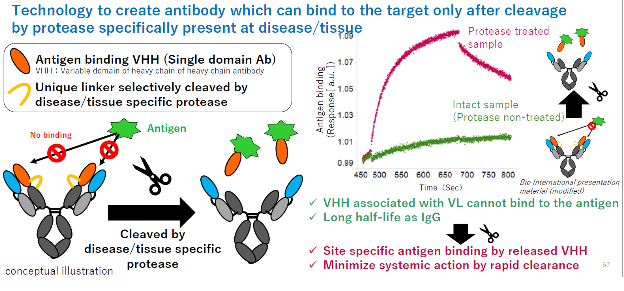
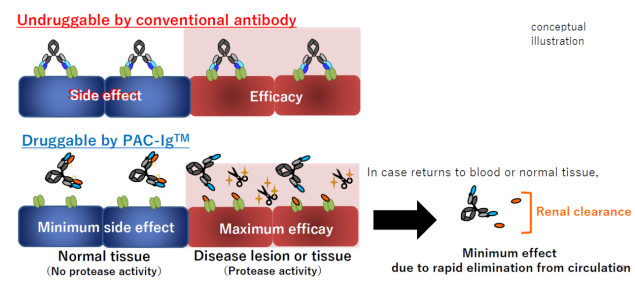
6.14 PAC-IgTM
PAC-IgTM(Protease ACtivated-Immunoglobulin)是利用肿瘤微环境中存在的高水平的特异性酶进行设计,其原理和已经报答的多种前药抗体技术相同。PAC-IgTM的设计如下图所示,发挥作用的纳米抗体(VHH)通过可以被切割的linker连接在抗体上。在没有达到肿瘤或者特定疾病组织,抗体的轻链对VHH抗体的结合表位进行阻挡,因此VHH抗体无法与抗原结合,并且因为抗体的Fc,PAC-Ig具有较长的半衰期。
当抗体进入疾病组织,linker被酶切割,释放可以结合靶标抗原的VHH对抗原进行结合并发挥作用。同时因为VHH分子量较小,因此其可以很快的被机体清除,从而不会在循环后对正常组织造成伤害。
6.15 MALEXATM(Machine Learning xAntibody)
MALEXATM主要是通过机器学习(类似于AI)来优化筛选抗体,其主要包含两个部分:MALEXA-LI和MALEXA-LO。其中MALEXA-LI是通过目前已有的技术如噬菌体库等筛选到候选的抗体。

MALEXA-LO主要是通过中外制药已经建立的高通量,自动化抗体筛选技术对候选的抗体进行进一步的优化,该平台可以在一周内完成上千个分子的测试和筛选。

MALEXA中的机器学习主要是在COSMO积累起的海量数据的基础上,建立合适的计算模型,并指导抗体的改造。这其中机器学习设计和实验验证相互依存,共同提高并完成最优抗体的筛选。

从日本首个抗体药物IL-6受体单克隆抗体注射剂(Actemra)问世开始,中外制药陆续推出各类抗体药物。近年来,公司进一步开发了该技术,生产了扫波抗体、双特异性抗体、开关抗体等专利技术。新的抗体工程技术具有发现无法治疗疾病药物的潜力,以及发现仍未知的新生物学和革命性治疗方法的潜力。
2005年,中外制药推出了第一款在日本生产的治疗性抗体Actemra,自进入日本市场15年以来,Actemra通过罗氏制药的渠道在全球110多个国家销售。该产品在宇都宫工厂生产,并运送给世界各地的患者,实现了公司成立之初的雄心——向海外提供日本药品。
中外制药正专注于下一代抗体技术的开发。公司于2010年10月在《自然·生物技术》上发表了一项名为“循环抗体”(Recycling antibody)的创新抗体工程技术,通过与抗原多次结合来延长药物的效果。另外,利用该技术开发的“sweep Antibody”具有用较少的抗体去除大量抗原的特点。2020年8月,首个基于循环抗体技术的药物萨他利珠单抗(Enspring)推出,用于治疗被认定为不治之症的神经脊髓炎谱系障碍(NMOSD)。
中外制药的另一杀手锏——双抗技术。传统的抗体只能与同一抗原结合,而“双特异性抗体”可以与两种不同的抗原结合,这使得一种非常规的药物发现方法成为可能。利用这项技术,中外制药在2018年5月推出了重组艾米希组单抗(Hemlibra)。
虽然治疗性抗体药物提供了一种小分子药物无法提供的治疗方法,但仍存在挑战。其中一个挑战是“靶内毒性”,即抗体一旦与靶分子结合,毒性就会增加。一种解决方案是2019年中外制药宣布的Switch抗体技术。Switch抗体被设计成仅在肿瘤微环境中“打开”或与目标抗原结合,但在正常组织中“关闭”或不与抗原结合。
因此,由于毒性增加而无法药物治疗的靶分子可以顺利进行治疗,极大地扩展了药物发现的边界。




 个人中心
个人中心
 我是园区
我是园区




