您还不是认证园区!
赶快前去认证园区吧!


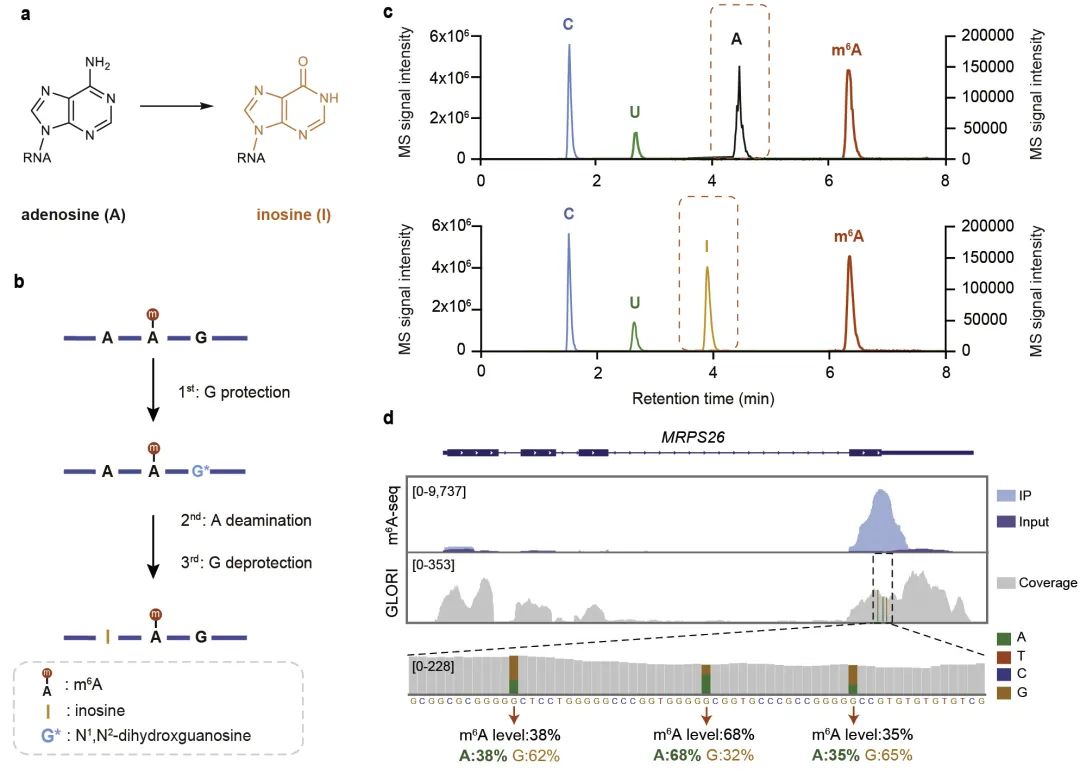
图1:GLORI 的检测原理。a, GLORI实现A-to-I的转化。b, GLORI的化学反应过程。c, GLORI中乙二醛和亚硝酸盐介导脱氨作用前后(上)和(下)的LC-MS/MS分析。d, GLORI技术在基因MRPS26上定量检测m6A位点的例子。
制版人:十一
参考文献
-
Perry, R. P. & Kelley, D. E. Existence of Methylated Messenger-Rna in Mouse L Cells. Cell 1, 37-42 (1974). -
Perry, R. P. et al. The methylated constituents of L cell messenger RNA: evidence for an unusual cluster at the 5' terminus. Cell 4, 387-394 (1975). -
Bokar, J. A. et al. Characterization and partial purification of mRNA N 6-adenosine methyltransferase from HeLa cell nuclei. Internal mRNA methylation requires a multisubunit complex. J. Biol. Chem. 269, 17697-17704 (1994). -
Bokar, J. A. et al. Purification and cDNA cloning of the AdoMet-binding subunit of the human mRNA (N 6-adenosine)-methyltransferase. RNA 3, 1233-1247 (1997). -
Liu, J. et al. A METTL3-METTL14 complex mediates mammalian nuclear RNA N 6-adenosine methylation. Nat. Chem. Biol. 10, 93-95 (2014). -
Ping, X. L. et al. Mammalian WTAP is a regulatory subunit of the RNA N 6-methyladenosine methyltransferase. Cell Res. 24, 177-189 (2014). -
Schwartz, S. et al. Perturbation of m 6A writers reveals two distinct classes of mRNA methylation at internal and 5' sites. Cell Rep 8, 284-296 (2014). -
Patil, D. P. et al. m 6A RNA methylation promotes XIST-mediated transcriptional repression. Nature 537, 369-373 (2016). -
Jia, G. et al. N 6-methyladenosine in nuclear RNA is a major substrate of the obesity-associated FTO. Nat. Chem. Biol. 7, 885-887 (2011). -
Zheng, G. et al. ALKBH5 is a mammalian RNA demethylase that impacts RNA metabolism and mouse fertility. Mol. Cell 49, 18-29 (2013). -
Wang, X. et al. N 6-methyladenosine-dependent regulation of messenger RNA stability. Nature 505, 117-120 (2014). -
Wang, X. et al. N(6)-methyladenosine Modulates Messenger RNA Translation Efficiency. Cell 161, 1388-1399 (2015). -
Shi, H. et al. YTHDF3 facilitates translation and decay of N(6)-methyladenosine-modified RNA. Cell Res. 27, 315-328 (2017). -
Roundtree, I.A. et al. YTHDC1 mediates nuclear export of N(6)-methyladenosine methylated mRNAs. elife 6 e31311 (2017). -
Hsu, P.J. et al. Ythdc2 is an N(6)-methyladenosine binding protein that regulates mammalian spermatogenesis. Cell Res. 27, 1115-1127 (2017). -
Yang, Y., Hsu, P.J., Chen, Y.S. & Yang, Y.G. Dynamic transcriptomic m(6)A decoration: writers, erasers, readers and functions in RNA metabolism. Cell Res. 28,616-624 (2018). -
Song, J. & Yi, C. Reading chemical modifications in the transcriptome. J. Mol. Biol. 6, 1824-1839 (2019). -
Wang, X. et al. N(6)-methyladenosine Modulates Messenger RNA Translation Efficiency. Cell 161, 1388-1399 (2015). -
Shi, H. et al. YTHDF3 facilitates translation and decay of N(6)-methyladenosine-modified RNA. Cell Res. 27, 315-328 (2017).




转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区





