您还不是认证园区!
赶快前去认证园区吧!


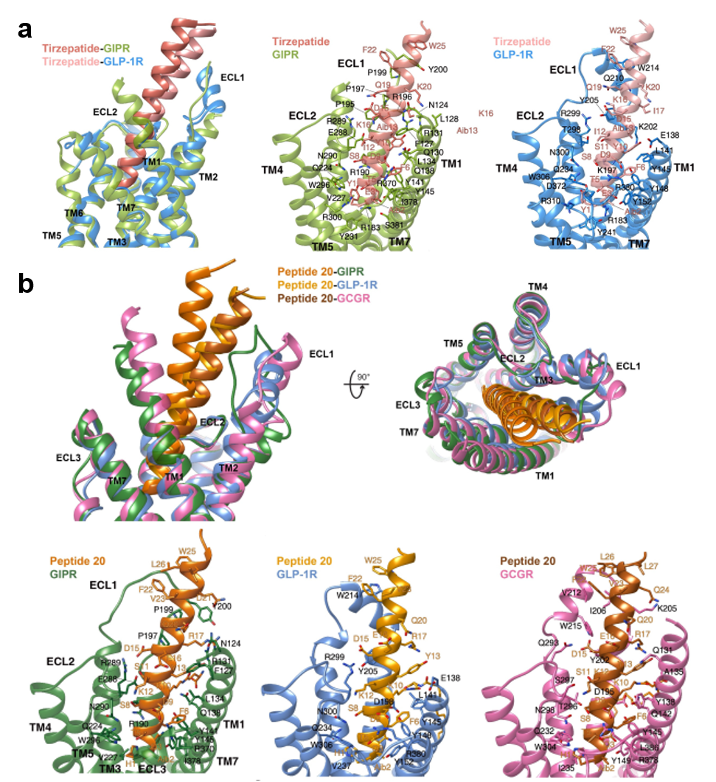
研究发现,双重和三重激动剂的N端都插入到受体跨膜域中,C端则与胞外域和胞外环1(Extracellular loop 1, ECL1)紧密相连。GIPR和GLP-1R被Tirzepatide激活后其ECL1、ECL3、transmembrane helix 1 (TM1)和TM3产生了独特的构象(图1a)。相比GLP-1R,结合GIPR后,Tirzepatide的C端发生了8.3°的偏转,使其与ECL1的相互作用明显减少。同样,去除侧链脂肪酸修饰后的Tirzepatide对GIPR构象的影响远大于对GLP-1R构象之影响,提示侧链修饰的重要性。与Tirzepatide相似,Peptide 20的C端决定了GIPR、GLP-1R和GCGR的特异性构象,引发三个受体的胞外域、ECL1和TM1产生不同程度的偏移或偏转(图1b)。Peptide 20的侧链(即脂化的16碳棕榈酸,K10P)位于第10位赖氨酸上(图2),它结合在三个受体的TM1和TM2之间,通过与受体的相互作用来稳定激活态构象。将三个受体TM1和TM2上与K10P相关联的氨基酸突变成丙氨酸,配体的激活效力显著降低。采用化学方法去除K10P修饰后的Peptide 20诱导cAMP信号的能力分别下降了1,288倍(GIPR)和759倍(GCGR),但不影响GLP-1R,进一步展现了侧链改造的药理学意义。

-
Yuliantie, E. et al. Pharmacological characterization of mono-, dual- and tri-peptidic agonists at GIP and GLP-1 receptors. Biochem Pharmacol 177, 114001, doi:10.1016/j.bcp.2020.114001 (2020). -
Nauck, M. A. & Meier, J. J. The incretin effect in healthy individuals and those with type 2 diabetes: physiology, pathophysiology, and response to therapeutic interventions. Lancet Diabetes Endo 4, 525-536, doi:10.1016/S2213-8587(15)00482-9 (2016). -
Campbell, J. E. & Drucker, D. J. Islet alpha cells and glucagon-critical regulators of energy homeostasis. Nat Rev Endocrinol 11, 329-338, doi:10.1038/nrendo.2015.51 (2015). -
Christensen, M., Vedtofte, L., Holst, J. J., Vilsboll, T. & Knop, F. K. Glucose-dependent insulinotropic polypeptide: a bifunctional glucose-dependent regulator of glucagon and insulin secretion in humans. Diabetes 60, 3103-3109, doi:10.2337/db11-0979 (2011). -
Frias, J. P. et al. Tirzepatide versus Semaglutide Once Weekly in Patients with Type 2 Diabetes. New Engl J Med 385, 503-515, doi:10.1056/NEJMoa2107519 (2021). -
Tschop, M. H. et al. Unimolecular Polypharmacy for Treatment of Diabetes and Obesity. Cell Metab 24, 51-62, doi:10.1016/j.cmet.2016.06.021 (2016).
End

推荐阅读
-
里程碑!PNAS | 人源全长PI3Kα复合物三维结构成功解析(附:邵峰院士、叶德全院长点评) -
PNAS | 生长激素释放激素受体的结构性信号偏向转导机制 -
PNAS | 人源甲状旁腺激素受体2复合物三维结构成功解析
-
eLife | 人源葡萄糖依赖性促胰岛素释放多肽受体三维结构成功解析
-
我国科研人员发现判断前列腺癌预后的潜在生物标志物
-
《自然•通讯》| 我国科学家发现B1类G蛋白偶联受体变构激动调节的分子机制 -
Cell Research | 人源胰高血糖素样肽-2受体复合物三维结构成功解析 -
Science | 解析新冠病毒奥密克戎文章!上海药物所徐华强团队发表 -
中科院徐华强/尹万超团队联合攻关新冠病毒奥密克戎(Omicron)变异株刺突蛋白及其与受体和抗病毒抗体的复合物结构 -
首发 | 中科院徐华强/尹万超团队联合攻关新冠病毒奥密克戎(Omicron)变异株刺突蛋白及其与受体和抗病毒抗体的复合物结构 -
喜报 | 上海药物所徐华强课题组多巴胺受体研究成果荣登Cell封面 -
讲座直播:2021年度诺贝尔生理学/医学奖花落谁家?| 药时代与返朴联合主办
-
炎炎红镜东方开,明朝日月换新天!——邵峰院士与邓天敬博士联手打造炎明生物
 点击这里,与~20万同药们喜相逢!
点击这里,与~20万同药们喜相逢!



 个人中心
个人中心
 我是园区
我是园区





