
肿瘤的发生发展是一个非常复杂的过程,涉及到众多的基因和信号通路。大约50%的人类肿瘤中,p53蛋白会因基因突变、缺失或者异常降解,导致p53抑制肿瘤功能的丧失。在一些肿瘤细胞中泛素E3连接酶MDM2过度表达,与p53蛋白结合并促进其泛素化降解,直接降低p53蛋白稳定性和活性,帮助肿瘤逃避打击【1】。基于此,以MDM2-p53为靶点设计开发全新机制的抗肿瘤药物,是当下全球肿瘤药物研发领域热点与重点之一【2】。此外,MDM2 还具有独立于p53的致癌活性,针对靶向MDM2的药物也在研究开发中【3】。目前,还没有批准针对靶向MDM2的治疗药物,MDM2的相关信号通路在肿瘤免疫学中仍知之甚少。
近年来,免疫疗法在肿瘤免疫治疗领域取得了巨大成功【4】。CD8+T细胞在肿瘤免疫中起到核心作用,并且是治疗效果和癌症患者预后的决定性因素【5】。尽管目前对MDM2 和p53信号通路在肿瘤细胞中进行了广泛的研究,但是该信号通路是否调控CD8+细胞介导的肿瘤免疫,靶向MDM2和p53信号通路是否可以改变宿主免疫系统进而影响靶向疗效,仍不清楚。
2021年3月25日,密西根大学邹伟平教授团队 (周佳佳博士为第一作者)在Nature Immunology上发表文章The ubiquitin ligase MDM2 sustains STAT5 stability to control T cell-mediated anti-tumor immunity,密西根大学王少萌教授为这一课题的关键合作伙伴。本研究揭示MDM2-STAT5信号通路调控T细胞介导的免疫学机制, 此项工作为开发以MDM2-p53为靶点的免疫药物及确定其肿瘤治疗适应症,提供新的思路。

在该项研究中,研究人员首先鉴定到激活的人类和小鼠CD8+T 细胞中高表达MDM2。为了探索MDM2如何调控T细胞的功能,研究人员构建了MDM2特异性的T细胞条件敲除小鼠模型。相对于野生型小鼠,MDM2敲除小鼠的肿瘤生长更快。进一步的研究表明,MDM2敲除的小鼠中, 大量的浸润CD8+ T细胞发生凋亡,进而影响CD8+T细胞的数量。此外,研究人员还构建了p53特异性的T细胞条件敲除小鼠模型。体内体外实验表明,MDM2调控CD8+T细胞的存活和功能不依赖于p53活性。
为了探索MDM2调控CD8+T细胞功能的分子机制,研究人员在多个细胞系中,通过分子生物学技术,发现MDM2特异性的调控STAT5的稳定性。鉴于MDM2的泛素E3连接酶的蛋白降解功能,发现MDM2能稳定STAT5蛋白,完全出乎意料。已有研究表明,鼠成纤维类细胞和人间充质基质细胞STAT5的稳定性受到泛素E3连接酶c-Cbl调控【6-7】。进一步研究表明,敲低MDM2的表达不影响c-Cbl的表达,敲低c-Cbl也不影响MDM2的表达。生化实验表明,MDM2阻止c-Cbl和STAT5的结合,减少了c-Cbl介导的STAT5降解,并增强了肿瘤浸润CD8+T细胞中STAT5的稳定性(图1)。
鉴于MDM2可阻止T细胞中的STAT5降解,并有助于T细胞介导的抗肿瘤免疫,增强T细胞中的MDM2蛋白表达可能会触发T细胞介导的抗肿瘤免疫并治疗癌症。研究人员发现,靶向MDM2-p53相互作用的有效小分子药物APG-115【8】会促进小鼠和人类T细胞中的p53和MDM2表达。有趣的是,用APG-115进行的治疗可抑制具有多种肿瘤类型的小鼠的肿瘤生长。进一步的研究发现,APG-115的抗肿瘤作用伴随着CD8 + T细胞在肿瘤微环境中的存活和功能增加,并且依赖于CD8 + T细胞。APG-115的抗肿瘤作用与肿瘤p53的遗传状态无关,但完全取决于宿主CD8 + T细胞以及CD8 + T细胞中p53和MDM2的存在。在临床上,MDM2的丰度与癌症患者的T细胞功能和IFNγ信号有关。体内靶向p53-MDM2相互作用会增加T细胞中的p53和MDM2,增强T细胞介导的抗肿瘤免疫,并协同免疫治疗。此外,该研究可以扩展对MDM2靶向药物的有效开发和选择范围。T细胞中的MDM2可作为针对MDM2靶向药物(包括那些正在临床开发中的针对肿瘤p53-MDM2抑制剂)治疗的临床试验的患者选择指标。值得一提的是,鉴于在体内抑制MDM2可能不可避免地针对T细胞中的MDM2,该研究质疑抑制肿瘤MDM2是否是一种有效的抗癌方法。令人振奋的是,靶向MDM2和p53相互作用的药物可以增加T细胞中的MDM2,诱导抗肿瘤免疫。这类药物的疗效不依赖于肿瘤p53状态。因此,疾病适应症扩展到p53突变的肿瘤。王少萌教授为APG-115设计者。APG-115经密西根大学授权给亚盛药业。已经进入临床试用。
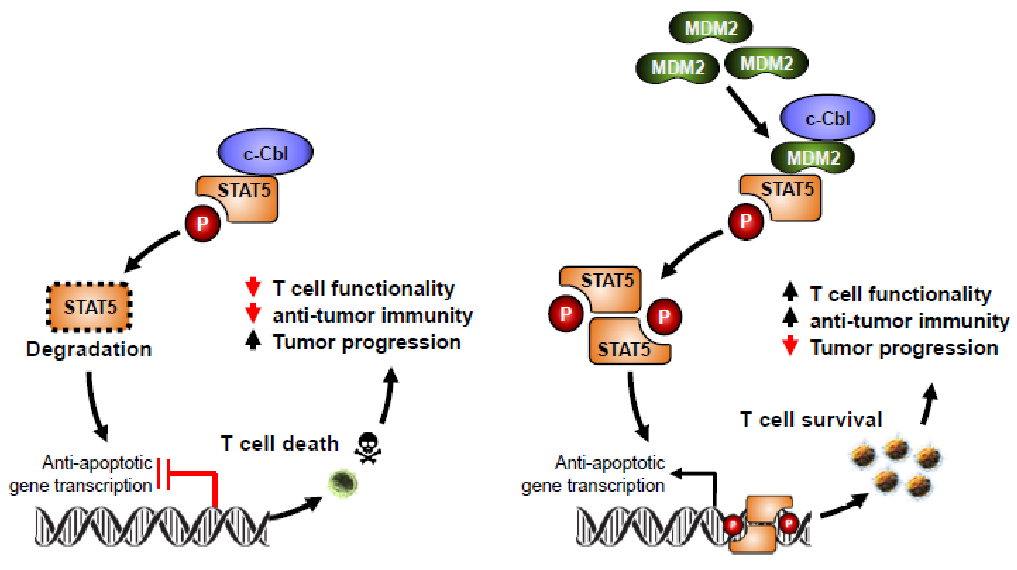
综上所述,本研究一方面揭示了MDM2调控CD8 + T细胞中的STAT5稳定性,这对于有效的抗肿瘤免疫至关重要;另一方面,从临床的角度,靶向p53和MDM2相互作用小分子药物APG115,可诱导CD8+ T细胞中的MDM2表达,稳定STAT5,增强T细胞功能,并与免疫疗法协同作用,而与肿瘤p53的状态无关。最后,本研究可能为寻找MDM2靶向药物提供参考,并有助于开展相关的临床试验。

附邹伟平课题组近期部分工作:
参考文献
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




