12 月 2 日,NMPA 官网显示,百济神州「注射用司妥昔单抗」获批上市。司妥昔单抗是百济与 EUSA Pharma 合作的两款单抗之一,用于治疗人类免疫缺陷病毒(HIV)阴性、人疱疹病毒-8(HHV-8)阴性的多中心卡斯特曼病(Castleman 病)成年患者。
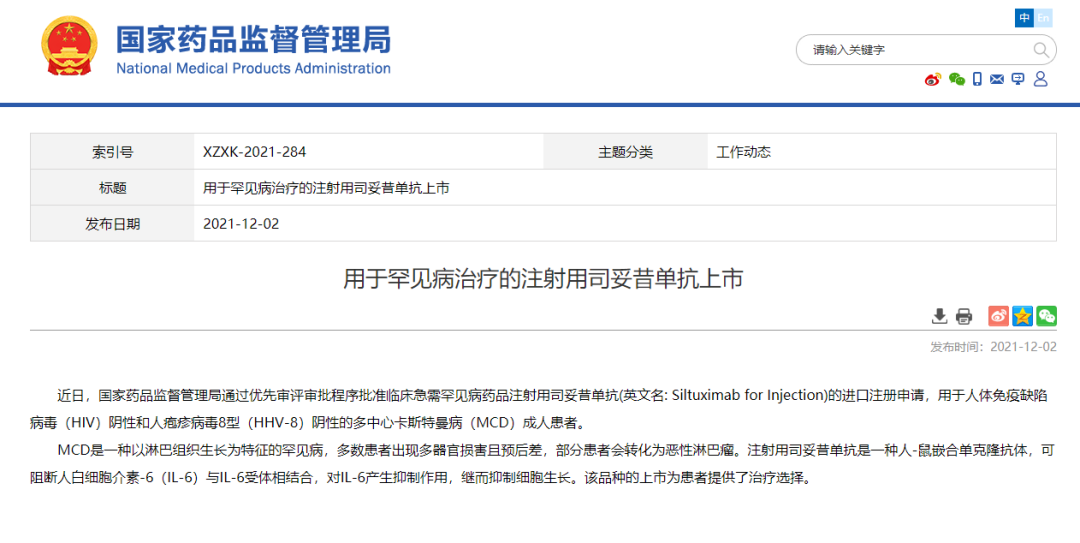
司妥昔单抗是一款 IL-6 单抗,用于阻断在卡斯特曼病患者中检测到升高的多功能细胞因子白细胞介素-6(IL-6)的活动。目前,该药已在多个国家和地区获得批准用于治疗 HIV 阴性、HHV-8 阴性的特发性多中心型 Castleman 病(iMCD)患者。
iMCD 是一种罕见、危及生命的衰竭性淋巴组织增生疾病,能够产生免疫细胞的异常增生,并在症状和组织学特征上与淋巴瘤有许多相似之处。iMCD 易于误诊,预后差,5 年死亡率高达 35%,而中国 MCD 患者由于缺乏有效的治疗手段,5 年生存率仅为 51%。由于发病率低,诊断困难,缺乏有效治疗手段,预后不佳,2018 年该病被纳入我国《第一批罕见病目录》。
2020 年 1 月 13 日,EUSA Pharma 与百济神州就两款孤儿药生物药 SYLVANT®(司妥昔单抗)及 QARZIBA®(达妥昔单抗 β)达成独家开发和商业化协议。
根据协议条款,百济神州将出资并接管上述药品在这些区域的临床开发和药政申报。EUSA Pharma 将获得一笔预付款以及在达到药政及商业化里程碑时,将有资格获得总计至多 1.6 亿美元的付款,还将有资格获得未来产品销售的分级特许使用费。
今日,百济引进的这两款孤儿药都已经获批上市。达妥昔单抗 β 获批早于司妥昔单抗,在今年 8 月获批。这两款新药都属于临床急需境外新药,其上市破除了国内相应患者无药可治的困境,使患者获得了新的治疗选择。
编辑:加一
PR 稿对接:微信 insightxb
投稿:微信 insightxb;邮箱 insight@dxy.cn
点击卡片进入 Insight 小程序
药品申报、临床、上市、一致性评价…
随时随地查!
↓↓ 点击解锁更多新功能



 个人中心
个人中心
 我是园区
我是园区




