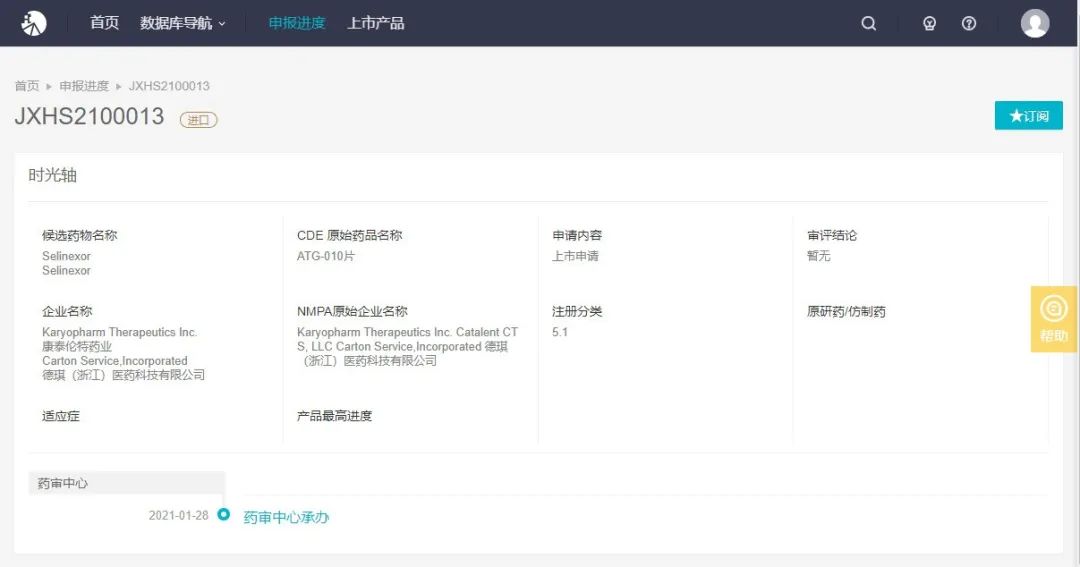
1 月 28 日,德琪医药-B 公布,国家药监局已受理该公司 ATG-010 (selinexor) 用于治疗复发难治性多发性骨髓瘤(rrMM)的新药上市申请,受理号 JXHS2100013。
ATG-010(selinexor,XPOVIO®)是同类首款且唯一一款口服型选择性核输出抑制剂(SINE)化合物,由 Karyopharm Therapeutics Inc. 研发,德琪医药进行研究。德琪医药拥有 ATG-010 在包括大中华区、韩国、澳大利亚、新西兰和东盟国家的多个亚太市场的独家开发和商业化权利。
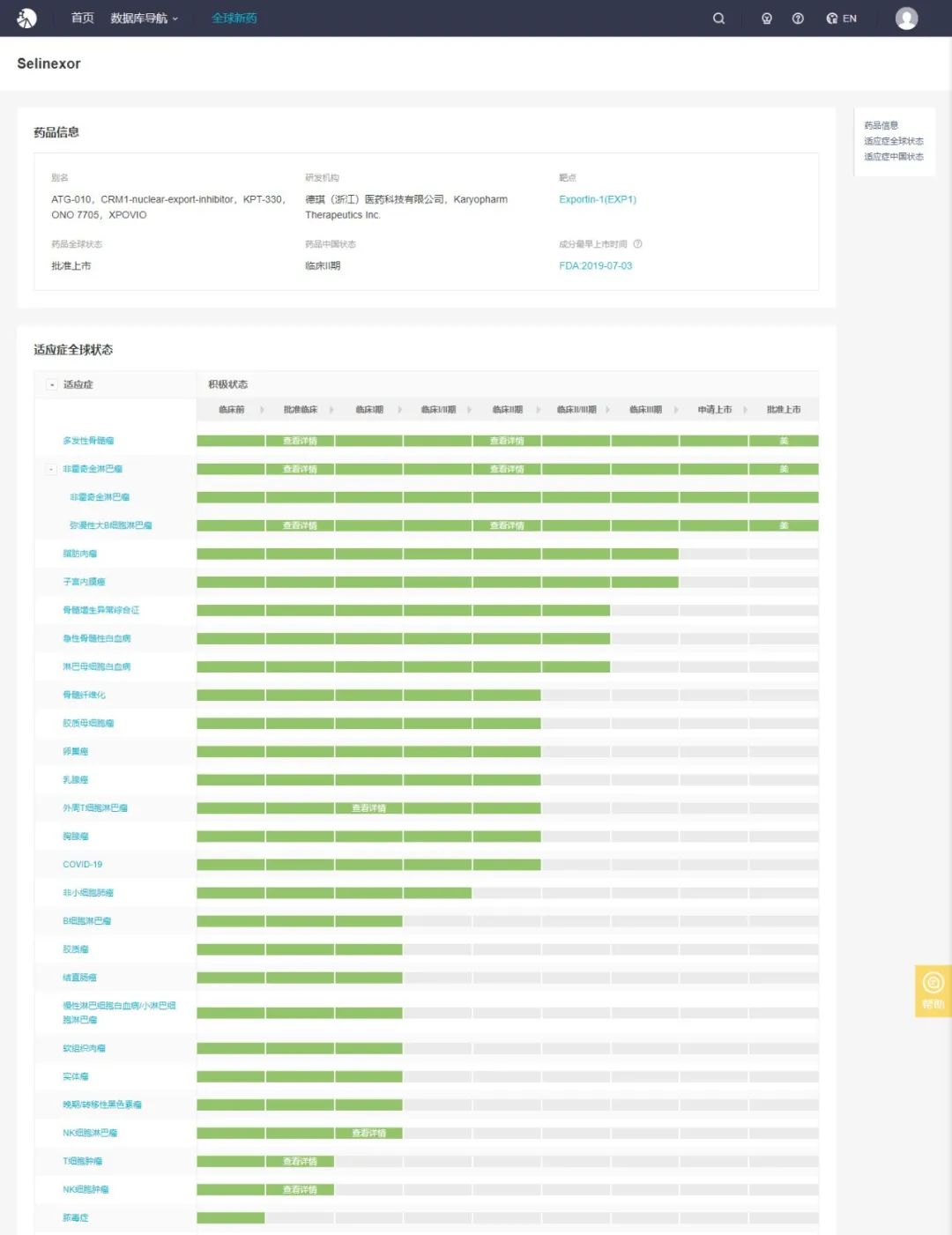
作为全球首个获得批准的 SINE 化合物,ATG-010 可以引起肿瘤抑制蛋白和其他生长调节蛋白的核内储留和活化,以及下调细胞浆内多种致癌蛋白水平,并在体外和体内诱导大量实体和血液肿瘤细胞的凋亡,而正常细胞不受影响。已有临床研究证明 ATG-010 对多种血液瘤及实体瘤均有明显疗效且安全性可控。
2019 年 7 月,FDA 批准 selinexor 联合低剂量地塞米松用于治疗难治复发性多发性骨髓瘤(rrMM)患者。2020 年 6 月,再次获 FDA 批准单药治疗难治复发性弥漫性大B细胞淋巴瘤(rrDLBCL)患者。同年 12 月,又获 FDA 批准联合治疗既往接受过至少一次治疗的多发性骨髓瘤患者。
Selinexor 是目前首款且唯一一款被美国 FDA 批准的口服 SINE 化合物,也是首款可用于治疗多发性骨髓瘤和弥漫性大 B 细胞淋巴瘤的药物。此外,selinexor 针对多个实体肿瘤适应症开展了多项中期和后期临床试验,包括脂肪肉瘤和子宫内膜癌。
来自 Insight 数据库(http://db.dxy.cn/v5/home/)
目前,ATG-010 治疗多发性骨髓瘤和弥漫性大 B 细胞淋巴瘤的 5 种治疗方案已被纳入美国国家综合癌症网络(NCCN)指南。
本次递交上市申请是德琪医药 ATG-010 在亚太地区继澳大利亚、韩国、新加坡和中国香港之后提交的第 5 个新药上市申请,也是在中国大陆提交的首个 SINE 系列化合物的新药上市申请,标志着中国血液肿瘤患者离这一全新的治疗选择更近了一步。

点击阅读原文
微信申请试用数据库 30 天




 个人中心
个人中心
 我是园区
我是园区




