
还是“原来”的靶点(FGFR2融合/重排),还是“熟悉”的药物(FGFR抑制剂)!2021年5月28日,FDA加速批准infigratinib上市,用于既往接受过治疗且携带FGFR2基因融合或其它重排类型的不可切除局部晚期或转移性胆管癌成人患者,同时,FDA还批准了FMI的F1CDx作为其伴随诊断!

此次批准对于诊断为FGFR2基因融合/重排、一线治疗后复发且需要针对性治疗方案的胆管癌患者来说,是一个重要的里程碑。
FGFR2蛋白由FGFR2基因编码制造,当它经历基因融合/重排并变得过度活跃时,它会帮助癌细胞生长和扩散,infigratinib与FGFR2蛋白结合以关闭FGFR2的过度活跃并阻止携带有该蛋白的癌细胞生长和扩散。

在胆管癌中,FGFR2基因融合的整体发生率约为9%~14%,在肝内胆管癌(iCCA)中发生率更高,可达45%。

FDA此次加速批准是基于一项多中心开放标签单臂II期试验CBGJ398X2204,该试验招募了108名既往接受过治疗的(至少接受过1次治疗)、不可切除的局部晚期或转移性胆管癌患者(99%的患者入组时为转移性IV期),这些患者通过当地或中心实验室检测确定具有FGFR2融合或重排。患者每天接受125mg infigratinib治疗,连续使用21天,休息7天,以28天为一周期,直到疾病进展或不可接受的毒性。
试验结果显示,总缓解率(ORR)达到23%,中位缓解持续时间(DOR)为5.0个月,32%患者的缓解持续时间(DOR)超过6个月。


FDA批准FMI的F1CDx作为infigratinib伴随诊断,以鉴定符合infigratinib治疗的胆管癌患者。
F1CDx是基于DNA-based NGS的体外诊断产品,可检测324个基因的SNVs,Indels,CNVs和 Rearrangements 四种变异类型及TMB(肿瘤突变负荷)和MSI(微卫星不稳定性)两种基因组特征,主要通过检测FGFR1/2/3基因内含子区域确定FGFR1/2/3重排类型。


FGFR2基因融合/重排,首先推荐用NGS方法来检测,其次,推荐用DNA-based或RNA-based NGS来检测,如条件允许,DNA+RNA-NGS或许更好(不作为临床检测推荐指导,仅供学习参考)。
① 为什么推荐用NGS方法来检测?
2020年3月20日发表于《The Lancet Oncology》的文章中 ,研究者们强调:鉴于胆管癌的分子多样性,此研究结果强调应将DNA-based NGS或RNA-based NGS检测分析方法作为FGFR2基因融合/重排的标准方法,检测FGFR2基因已知、新发融合或重排类型,从而识别出所有可能受益于FGFR靶向治疗的胆管癌患者。因此,更推荐用NGS方法来检测FGFR2的变异情况。

② 为什么DNA+RNA-NGS检测或更好?
FGFR2基因融合的检测方法,主要有四种:IHC,FISH,RT-PCR及NGS(DNA/RNA),各有优劣势。
IHC检测FGFR2融合,即检测FGFR2蛋白的表达量(基因融合致使表达量增加),这种方法适用于基础组织中基因蛋白表达量比较低的,基础组织中基因蛋白表达量比较高的,自然就不太适用了。优势就是医院可以自己做,检测结果快,相对还便宜;劣势就是必须使用组织进行检测,有显著的假阳性(FP)或假阴性(FN),需要特殊的组织和多目标部位检测。IHC虽可用于筛查诊断,但还推荐进一步证实基因融合的情况。
FISH检测FGFR2融合,即检测 FGFR2基因的断裂情况。优势就是医院可以自己做,检测结果快;劣势就是必须使用组织进行检测,同时,对于检测结果的解释具有挑战性,比如cutoff值的判断,也有显著的假阳性(FP)或假阴性(FN),需要特殊的组织和多目标部位检测,如果是单探针检测,自然也无法知道partner基因是谁了。FISH检测可直接告诉我们是否发生了基因融合,但还推荐进一步证实partner基因是谁(不同partner基因疗效有时也有差异)。
RT-PCR检测FGFR2融合,即反转录PCR检测FGFR2已知融合基因的情况,RNA → cDNA再扩增检测,可检测组织或血液。优势就是检测速度快,相对便宜;劣势就是不能检测未知的融合partner基因,一般不能一次检测多种融合基因。RT-PCR虽可检测基因融合情况,但需要预先知道融合基因是谁,断点在什么位置,才能设计针对性的PCR引物标识出已知融合partner基因的断点,对于未知的融合基因,自然就有点“束手无策”。
NGS检测FGFR2融合,根据核酸样本类型,可分为DNA-based NGS检测和RNA-based NGS检测两种,检测灵敏度、特异性均比较高,可检测组织或血液。DNA-NGS检测,自然要覆盖FGFR2基因的所有内含子区域,才不至于漏检(内含子区域覆盖度很低则会漏检),当然探针及测序成本就会更高,同时,检测到的融合可能表达,也可能不表达,但是DNA-NGS可以直接检测位于内含子区域的剪接突变及其他突变类型;RNA-NGS检测,不存在内含子区域覆盖不到的问题,检测结果相对更准确,但是RNA检测对于RNA的质量要求比较高,因为RNA较DNA更容易降解。NGS可检测基因融合(已知/未知)的情况,但RNA-NGS检测可能比DNA-NGS检测更可取,因为它可以识别出主动转录的基因嵌合融合,综合来看,DNA+RNA-NGS或许更好。
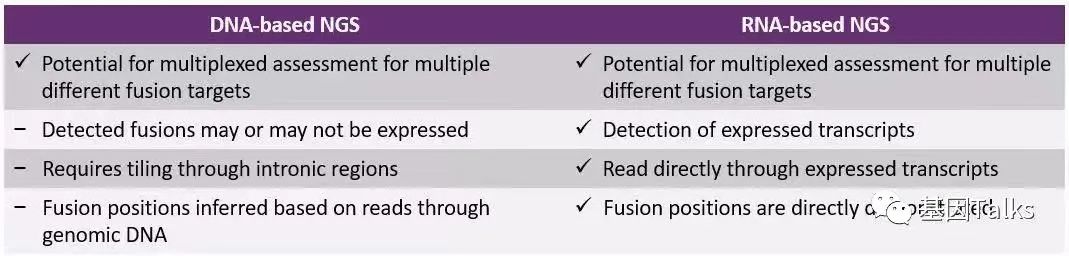
通过对四种基因融合检测方法的分析,我们可以发现,NGS技术其实是过往基因融合检测方法的“升级”,不仅可以检测基因融合,还能检测到已知和未知的融合基因,包括其它可能出现的基因重排现象。至于选择 DNA-NGS,RNA-NGS,还是DNA+RNA-NGS上面已经作了简要的分析(不作为临床检测推荐指导,仅供学习参考)。
参考资料:
1.https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-pemigatinib-cholangiocarcinoma-fgfr2-rearrangement-or-fusion
2.https://www.fda.gov/news-events/press-announcements/fda-approves-first-targeted-treatment-patients-cholangiocarcinoma-cancer-bile-ducts
3.https://www.fda.gov/drugs/drug-approvals-and-databases/fda-grants-accelerated-approval-infigratinib-metastatic-cholangiocarcinoma
4.https://massivebio.com/bile-duct-cancer-and-fgfr-clinical-trials
5.Katoh Masaru,Fibroblast growth factor receptors as treatment targets in clinical oncology.[J] .Nat Rev Clin Oncol, 2019, 16: 105-122.
6.Vogel A, Sahai V, Hollebecque A, et al. FIGHT-202: a phase 2 study of pemigatinib in patients (pts) with previously treated locally advanced or metastatic cholangiocarcinoma (CCA). Presented at: 2019 ESMO Congress; September 27-October 1, 2019; Barcelona, Spain. Abstract LBA40.
目前已有500+行业精英加入基因俱乐部
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()




 个人中心
个人中心
 我是园区
我是园区




