生物制品安全性的重要考量:关于病毒清除工艺的评价与鉴定
收藏
关键词:
生物病毒关于
资讯来源:生物制品圈 + 订阅账号
发布时间:
2022-03-09
治疗用生物制品的病毒污染是用药安全的重要风险之一。上世纪曾经发生过多次由于病毒污染而引发的严重安全性事件。20世纪八九十年代曾经日本、美国、法国、德国等国家血友病患者因使用病毒污染的血液或血液制品感染HIV或者HCV的严重事件,上万人感染HIV,造成严重的后果。工程菌和工程细胞生产生物制品的过程中也发现过中间产物存在病毒污染的报道。随着对病毒的了解,检测技术的进步以及病毒清除/灭活技术的运用,病毒安全在逐步提高。
外源性病毒污染源:
物料(表达载体构建和生产制造过程中,可能使用的动物来源或动物来源成分的物料,如牛血清、胰蛋白酶等;可能被病毒污染的化学培养基等);人员自身或未按规程操作;设施环境(密封问题、设备清洁问题,交叉污染等)
内源性病毒污染源:
生产用工程细胞和细菌,本身可能使用了病毒载体或者细胞本身内源性的病毒样颗粒;组织或体液等
《中国药典》2020、ICH Q5A、ICH Q5D、FDA《Points to Consider in Manufacture and Testing of Monoclonal Antibody Products for Human Use》、EMA《Guideline on Virus Safety Evaluation of Biotechnological Investigational Medicinal Products》等法规或指南都对病毒安全做出了要求或说明。国内外在关于病毒安全的法规方面要求基本一致,可概括为三条:
(1)对细胞系和其他原料(包括各种培养基)进行选择和检测,以确保不含有致人感染或致病的病毒
干热处理灭活法:
作为非特异的病毒灭活方法,对于脂包膜和部分非脂包膜病毒均可灭活,处理凝血因子等。
巴氏消毒法:
可有效灭活脂包膜病毒和非包膜病毒处理血液制品比较理想
有机溶剂/表面活性剂(S/D)法:
破坏脂包膜,对脂包膜病毒有效,对于非脂包膜病毒无效。
低pH孵育:
对脂包膜病毒有效,对于非脂包膜病毒作用弱。
层析(色谱):离子交换层析,疏水层析和反向层析,亲和层析等
ICHQ5A中指出:病毒去除和/或灭活方法的评价和鉴定对生物技术产品的安全性起着重要的作用。病毒清除研究的目的是评价那些被认为可有效灭活/去除病毒的工艺步骤,并定量评估病毒的整体下降水平。具体做法是有目的地将一定量的病毒加入到原料和/或各工艺步骤的抽样样本中去,通过研究在后续工艺步骤样本中的病毒量来确定该工艺步骤对病毒去除/灭活的效果。
在评定每一生产工艺步骤时,都应说明使病毒失去感染性的可能的机制,即究竟是被去除还是被灭活。
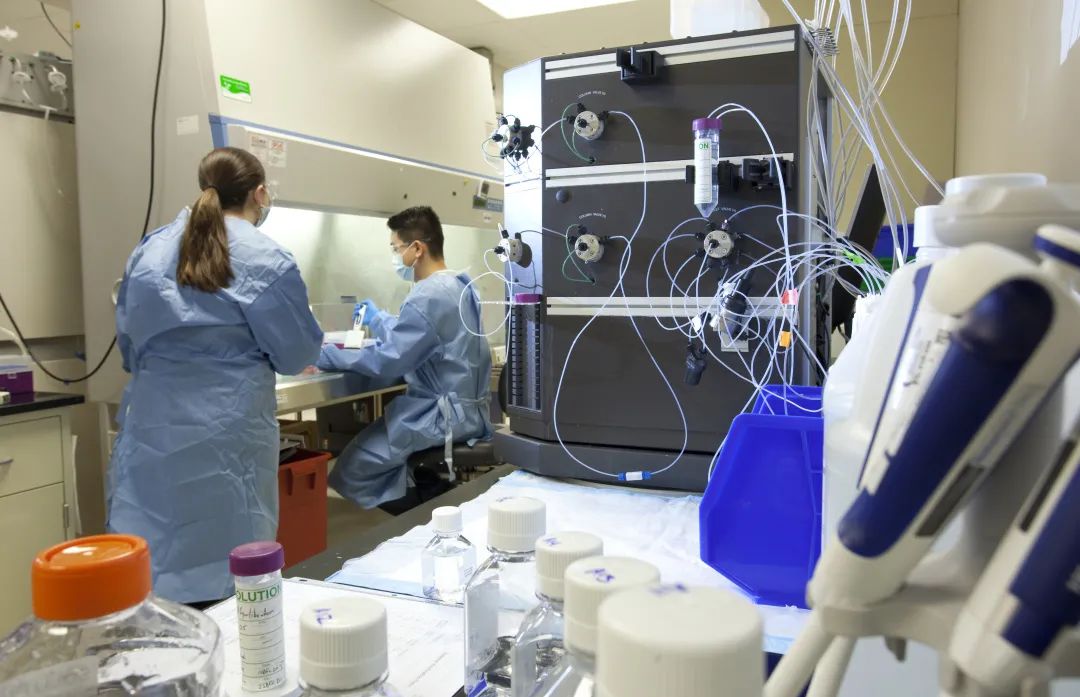
GMP规定不能将任何病毒引入生产设施,因此病毒清除研究需要在专门用于病毒学研究的隔离的实验室进行。并进行缩小规模生产体系验证。
病毒清除研究需要指示病毒,包括“相关病毒”,特异性“模型”病毒和非特异性“模型”病毒。
因此,病毒清除研究需要有专门设施、专业人员、指示病毒库资源等硬性指标。同时,作为关系生产安全的重要指标以及药品申报所必须的材料,应该选择具备丰富实践经验和全球影响力的供应商,以满足产品安全和法规的各项要求。
Charles River的科学家们在设计和开展病毒和传播性海绵状脑病(TSE)因子清除研究方面拥有近30年的经验。Charles River在欧洲和美国设有实验室,拥有的技术和法规专业知识可确保研究符合客户目标市场中所需满足的相关指导原则(例如,欧盟、美国、日本和世界卫生组织,包括ICH Q5A)。
明智、量身定制的研究设计以及可靠及时的报告构建了成功且具有成本效益的方案,可以满足各种生物制药产品的独特需求。Charles River已经支持了一系列产品,包括单克隆抗体(mAbs)、重组蛋白、转基因产品、组织和血液制品、疫苗和医疗器械等。此外,Charles River的团队还提供病毒清洁验证服务。
生物制药工艺的关键部分在于证明该工艺可以适当地去除或灭活任何已知和潜在未知的污染物。生产动物源或人体组织来源的生物药产品或辅助材料,如血液制品、重组蛋白、疫苗、激素、多克隆抗体、酶、甚至一些含有动物或人体血液来源成分的医疗器械,制造商需要证明其纯化和制造工艺能够灭活或去除病毒,对于某些产品,还需要证明其去除TSE因子的能力。
Charles River为客户进行了2500多项研究,这一研究数据库可指导开发、执行和评估满足和适合客户需求的病毒/TSE清除研究。从协助建立缩小工艺到报告生成,Charles River将提供整套研究设计和实施方案、以及一份支持注册申报的报告,以支持和加速您的药物报批流程。
基于风险的评估—对客户的病毒安全性检测方案、生产工艺和原料质量进行全面审查,以尽可能减少所需的病毒清除验证并确保更加符合科学性及成本效益的研究设计整体研究设计—审查所需的预试验、挑战病毒、采样模式、检测方法和检测方法灵敏度,以确定更有效的病毒清除研究方案。
优化的灵敏度—标准方案中包括的大体积检测应用于所有产品相关样品,以提高LRV值并证明有效且显著的病毒减少;
法规专业知识—将研究设计和报告与产品的开发阶段保持一致,且符合美国FDA、EMA、ICH以及其他国家特定法规文件中的相关要求;
定制服务—对不同类型的生物制品和纯化步骤的丰富经验,使Charles River能够针对每种产品及其要求提供量身定制的支持和建议,包括协助建立缩小工艺、操作工艺步骤以及对结果进行解释和疑难解答;
病毒清除研究领域近30年资深经验—研究应用多年累积的Charles River内部最佳实践,这些实践经内部研究确定,并在多次病毒安全性会议、专题讨论会、出版物和技术报告中介绍,以定义科学合理的研究设计。
Charles River在美国和欧洲均设有专属的病毒清除机构与设施。两处机构的程序已经同步统一,以便全球客户群轻松转移和实施病毒清除研究。每个机构都提供专门的客户实验室和客户专属办公室,以方便您能在现场访问期间实现更高的效率。现场提供有各种合格且经过验 ÄKTAexplorer/purifier/pure/avant 层析系统。
Charles River提供大量附加服务,在规划和执行病毒清除项目的过程中为客户提供充分的支持。Charles River的科学家精通包括层析在内的各种工艺步骤,可选择由这些科学家执行工艺步骤而无需客户亲临现场。
Charles River的法规顾问可以帮助确保方案满足美国、欧盟、日本和其他国际性要求,甚至可以陪同客户共同完成监管机构访问和/或在监管机构审计期间出席。
此外,Charles River还可以提供专家声明、病毒风险评估以及现场客户研讨会和培训。Charles River重视合作伙伴关系,致力于提供超越客户期望的品质服务。全面而灵活的报告、mycharlesriver安全的在线客户数据门户网站以及专职的项目经理,这一切均致力于实现Charles River的目标:进行清晰一致的沟通且按时交付项目。
样品收到后,通常4-8周出报告。根据实验室排期和预实验及验证实验而有所不同。
Charles River成立于1947年,总部位于马萨诸塞州威尔明顿,全球范围内拥有员工18400多名,面向全球领先的制药、生物技术、农药、政府和学术机构等客户,提供基础研究、发现、安全性和有效性、临床支持和生产等服务项目。
在过去的2021年,Charles River成功支持了86%的FDA批准上市新药的开发:
Charles River为全球客户提供生物制品检测整体解决方案,结合50多年在生物制品领域的深入实践和长期经验,为客户提供众多GMP或GLP检测方法以满足不同地区监管要求;平均每年接受超过200次的客户审计和6次法规部门的审计。每年执行超过10万次检测和出具超过2万份报告。
同时Charles River 生物制品检测团队为中国客户提供本地化的项目管理和客户支持服务。
Charles River
生物制品服务

本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。








 药选址
药选址







