

 来源:Biogen官网
来源:Biogen官网


更重要的是,Lecanemab的临床试验在主要终点的选择上并非使用了“淀粉样蛋白清除率”这样的生物标志物替代终点,而是症状改善这样的硬终点。此前Aduhelm获批引发巨大争议的原因之一,就是FDA引用了Aduhelm减少大脑中β淀粉样蛋白斑块的证据以证明此举的合理性。
Clarity AD研究使用了CDR-SB评分(总分0-18分,分数越高代表患者认知功能和日常生活能力越差),1795名早期AD患者按1:1的比例随机接受安慰剂或Lecanemab治疗。
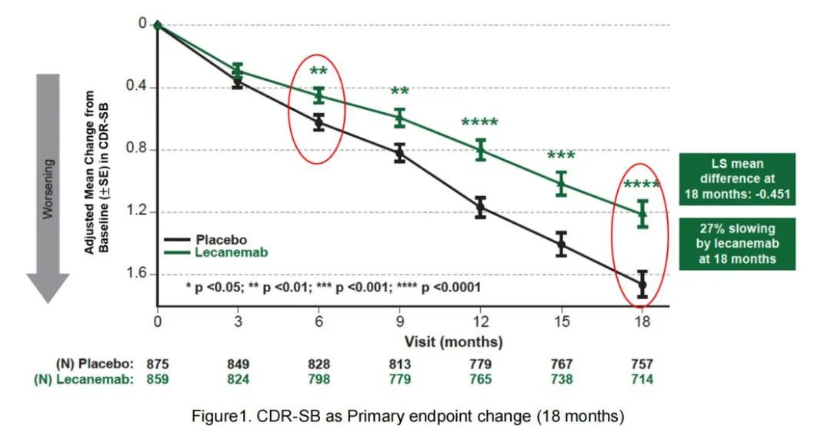 来源:卫材官网
来源:卫材官网

1944年6月6日早上6点30分,一项代号为“霸王行动”的军事行动在前后计划了两年多后终于启动,17.6万名来自英、法、美的盟军先头部队从英国横渡英吉利海峡奔向欧洲大陆,希望在欧洲大陆的西海岸展开攻势,抢滩登陆。
这场战役大获成功,共计288万名盟军士兵从5个海滩登陆,如潮水般涌入法国,使第二次世界大战的战略态势发生了根本性的变化。这场登陆战过于经典,被后世称作“人类史上最大的两栖登陆战”,也就是大名鼎鼎的诺曼底登陆。
Lecanemab的获批,就如同人类反攻阿尔茨海默病的诺曼底登陆,形势发生转变,尽管刚刚开始,却意义重大。
除了Lecanemab外,礼来的Donanemab也将在2月份迎来自己的PDUFA date。
礼来是对Aduhelm获批反应最激烈的药企之一,因为自己的另一款阿尔茨海默病产品solanezumab 试验结果与Aduhelm类似却并未获批,本来已经兴致阑珊的礼来被Aduhelm的获批激起了斗志,将Donanemab的三期临床试验设计成了与Aduhelm的头对头比较。
在卫材/Biogen公布Lecanemab的完整试验结果后的第三天,礼来也公布了Donanemab与Aduhelm的头对头试验结果——完胜Aduhelm。
只不过在终点设定上,礼来选择了大脑中淀粉样蛋白的清除率作为疗效替代终点。在经过6个月的治疗后Donanemab和Aduhelm组患者达到淀粉样蛋白斑块完全清除的比例分别为37.9%和1.6%,淀粉样蛋白斑块水平分别比基线水平降低了65.2%和17%。
单从蛋白清除效率上来讲,Donanemab可以说是目前最强药物。有Aduhelm获批在前,FDA似乎没有不批Donanemab的理由。
Aduhelm、Lecanemab、Donanemab这“Aβ三巨头”是在这条路上走的最远的药物,而且已经快走到头了,如果能在长期研究中持续展现出优秀的治疗效果,那么还可以继续在蛋白清除效率、安全性等方面优化,如果发现了治疗瓶颈,那阿尔茨海默病的未来还是要落到其他机制的药物上。
从这个角度上来看,无论是否认可“Aβ假说”,我们都应该乐于接受“Aβ假说三巨头”的取得的成果。





这些「抗新冠药物」今年上半年可能在华获批!都有哪些优势?

出海无小事!看全球临床供应领军企业Catalent如何做到「事无巨细」,助力中国药企扬帆出海
小公司PK大公司PK学术界:谁发现更多的FIC抗癌药?谁是创新实力派?
推荐阅读
-
这些「抗新冠药物」今年上半年可能在华获批!都有哪些优势?
-
出海无小事!看全球临床供应领军企业Catalent如何做到「事无巨细」,助力中国药企扬帆出海
-
小公司PK大公司PK学术界:谁发现更多的FIC抗癌药?谁是创新实力派?
-
国内获批上市的新冠治疗药物都是什么靶点?效果如何?什么价格?哪些优缺点? -
吴一龙教授 | 我的2022 -
让立项晚的药物「弯道超车」,临床失败的药物「起死回生」,生物标志物有何魔力? -
药时代BD-041项目 | 高结合力、高效能PD-1xPD-L1双抗I期项目 -
我在Nature上,找到了这些值得在2023年关注的事......
-
FDA今年批准上市的创新疗法大盘点:TCR双抗、国产CAR-T……
 药时代BD高阶研讨会火热报名中!
药时代BD高阶研讨会火热报名中!



 个人中心
个人中心
 我是园区
我是园区





