▎药明康德内容团队编辑
2021年12月15日,Pharma Two B公司宣布,P2B001在早期帕金森病(PD)患者中进行的一项3期临床试验达到其主要和关键次要终点。P2B001是普拉克索(pramipexole,0.6 mg)和雷沙吉兰(rasagiline,0.75 mg)缓释制剂的一种新型固定剂量组合,两种成分的剂量均低于其各自上市产品剂量。试验结果表明,P2B001与它的两种药物成分单药治疗相比,疗效更为显著。并且,P2B001与上市的普拉克索缓释疗法相比,在疗效相似的情况下,显著减少患者日间嗜睡症状,伴有卓越的安全性。这些积极结果证明了P2B001作为早期PD患者一线疗法的潜力,Pharma Two B计划于明年向美国FDA递交该复方制剂的新药申请(NDA)。

PD是仅次于阿尔茨海默病的第二常见的神经退行性疾病,全球约有1000万PD患者。PD主要运动症状表现为静止时四肢震颤、僵硬和运动功能受损,非运动症状包括认知、情绪、以及睡眠障碍。产生PD的原因是由于患者的黑质(substantia nigra)中制造多巴胺的神经元死亡。目前对PD的治疗方法为左旋多巴(L-DOPA),或者其它多巴胺激动剂。但是长期服用左旋多巴可能会导致运动并发症的发生,从而加重病情且降低生活质量。
普拉克索是一种多巴胺受体激动剂,能够高度特异性地与多巴胺受体D2亚家族结合,可单独或与左旋多巴联用治疗PD。而雷沙吉兰是一种单胺氧化酶抑制剂,能延缓神经递质多巴胺的分解,作为左旋多巴和卡比多巴的辅助剂治疗PD。作为两种药物的低剂量缓释联合制剂,P2B001只需每天给药一次,无需滴定,在给药上十分方便。
该3期临床试验达到其主要终点,即与药物两种成分的单药治疗相比,P2B001组患者的统一帕金森病评定量表评分(UPDRS)较基线的改善幅度更大。具体而言,P2B001组优于普拉克索组2.66分(p=0.0018),优于雷沙吉兰组3.30分(p=0.0001)。
除了UPDRS的主要终点,在试验关键次要终点上,P2B001表现出与上市普拉克索缓释剂(滴定至每个患者的最佳剂量;1.5-4.5 mg)类似的疗效,并且白天嗜睡症状降低了2.66个点(p<0.0001)(通过Epworth嗜睡量表评估)。在12周后,P2B001组(-7.98分)和上市普拉克索缓释剂(-8.35分)的总UPDRS评分显示出相似的变化。
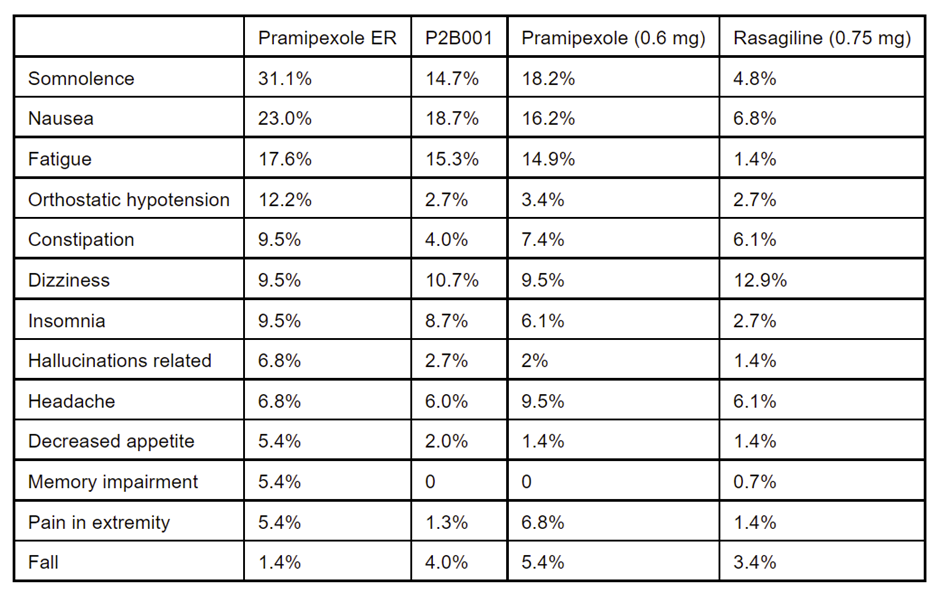
安全性上,P2B001通常耐受性良好,超过98%的治疗后不良事件(TEAE)的严重程度为轻度或中度。各治疗组的早期治疗终止率相似(在7.1%-9.1%之间)。
Pharma Two B的首席执行官Sheila Oren博士表示:“我们对该3期临床试验的积极结果感到兴奋。早期PD治疗存在明显未满足的医疗需求,这种新治疗组合已被证明可以显着改善患者运动症状和日常生活功能,同时伴随很低的副作用。相关数据支持我们的观点,即P2B001可以提供与更高剂量的上市多巴胺激动剂相似的临床益处,同时减轻通常与此类药物相关的副作用,例如嗜睡、体位性低血压和幻觉。这对所有年龄段的PD患者都很重要,尤其是老年人,他们通常不能耐受多巴胺激动剂的副作用。”
参考资料:
[1] Pharma Two B Announces Positive Topline Results from its Pivotal Phase III Study of P2B001 in Early Parkinson's Disease. Retrieved December 15, 2021, from https://www.prnewswire.com/news-releases/pharma-two-b-announces-positive-topline-results-from-its-pivotal-phase-iii-study-of-p2b001-in-early-parkinsons-disease-301445237.html
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。








 个人中心
个人中心
 我是园区
我是园区




