
最近,有新从事临床试验的朋友提问:肿瘤I期临床试验,DLT得如何设定标准,评估期得设置多长的时间,理由是什么?
关于DLT,如果要真正搞懂,有好几个问题需要厘清。
Ⅰ期临床试验主要是为了对新药的人体药代动力学和耐受性进行初步试验,并为后续的临床试验推荐最佳的给药方案。
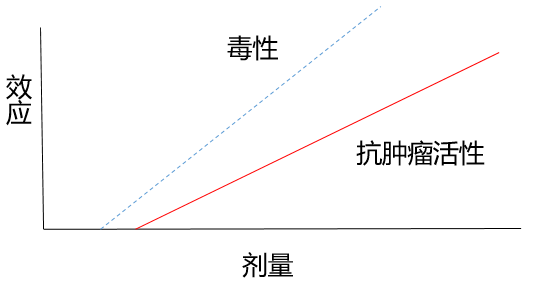
理论上来说,得找到一个获益风险比最佳的剂量,也就是在该剂量,有效性与毒性处于最佳的平衡点。
传统的细胞毒化疗药物,一般来说,有这么一个特点:药物剂量越大,其疗效越好,毒性也越大。也就是说,剂量与疗效/毒性呈线性递增关系。
只要找到毒性可以耐受的最大剂量,即最大耐受剂量
(MTD)
,该剂量就是最佳的给药剂量。
当然,很多新的抗肿瘤药物
(例如靶向治疗、免疫治疗)
,剂量与疗效以及毒性不一定是简单的线性递增关系,这个话题我们暂且略过不提。
首先定义一系列毒性,这些毒性达到某种严重程度就可能让受试者难以耐受,这一系列毒性就是剂量限制性毒性(Dose-limiting toxicity,DLT)。
基于临床实践,一般先设定一个阈值,DLT发生的概率小于该阈值就认为可耐受。
例如传统的3+3爬坡方法,DLT发生概率的阈值X设定为 1/6 ≤ X <1/3。而基于模型或者模型辅助的方法, DLT发生概率的阈值可以根据临床实践灵活选择。
DLT的标准,不同的试验药物不同的临床试验不一定完全相同。
与试验药物有关的≥ 3级的非血液学毒性
与试验药物有关的≥ 4级的血液学毒性
有些毒性,即使达到3级,但有药物能够治疗,受试者可以耐受,就不一定需要定为DLT。
在G-CSF(粒细胞集落刺激因子)出现之前,“≥ 3级中性粒细胞减少”就认为是DLT;在G-CSF出现之后,很多试验把 “≥ 4级中性粒细胞减少”才认为是DLT。
在使用酪氨酸激酶抑制剂(TKI)治疗后,经常会出现一过性的、无症状的3级血生化异常或高血压,不一定需要干预,或者通过口服降压药就可以缓解。这些3级毒性往往也不需要设定为DLT。
反过来,有些毒性,即使严重程度 < 3级,但长期存在导致受试者难以耐受,或者危险性很大,也需要设定为DLT。
例如,试验药物如果是免疫检查点抑制剂,2级免疫性心肌炎,也需要考虑设定为DLT。
在试验期间的任何时候,受试者都可能出现DLT事件。不可能等待每个受试者完成整个试验,再根据期DLT发生概率进行剂量递增或者递减的决策。
因此需要设定一个期限作为DLT评估期,完成该评估期的评估,就进行剂量增减的决策。
传统的细胞毒化疗药物,多数是间断性周期性给药。DLT评估期往往都设定为第一个给药周期
(C1)
,例如21或28天。
但是,对于新的抗肿瘤药物,其毒性可能是累积性的,也可能延迟发生,只观察第一个给药周期的DLT发生概率,不一定能真正反映该药物的安全性以及耐受性情况。
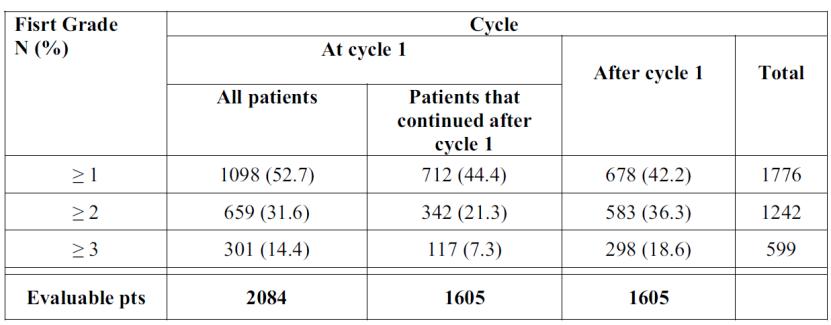
例如,一个回顾性研究共纳入54项I期试验,这些试验包括2084名患者,评估了35种针对不同靶点的药物
(均为靶向治疗药物)
,在599名出现 ≥ 3 级毒性的受试者中,约有一半(49.7%)的受试者在第一个周期后才首次出现≥ 3 级毒性。
另外,与免疫治疗相关的毒性,也称为免疫相关不良事件
(irAEs)
,很少发生在第一个周期,通常发生时间为首次给药第4周以后、头3个月内(输液相关反应除外)。
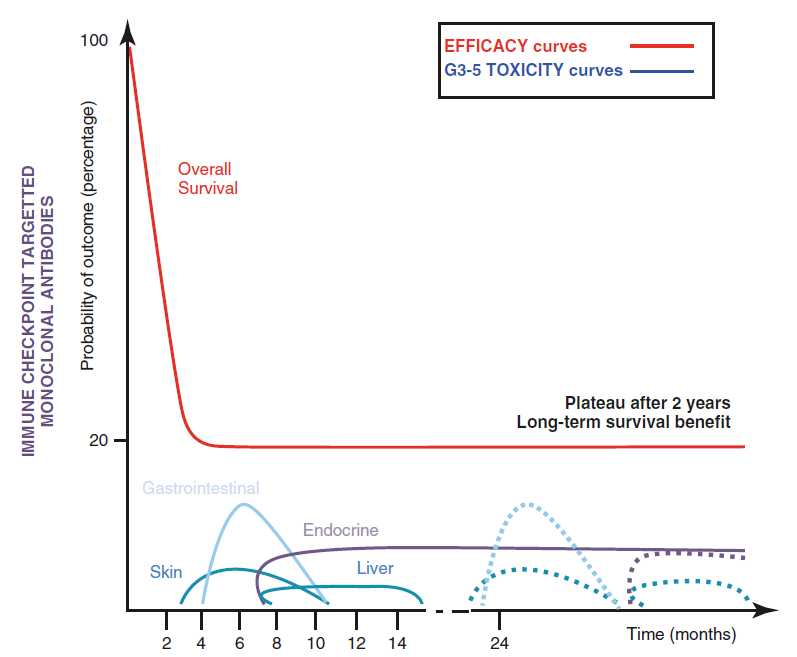
免疫检查点抑制剂的总生存(OS)曲线和3-5级严重免疫相关不良事件(irAEs)的概率
因此,DLT评估期如果只考虑第一个周期观察到的毒性很可能是不合适的,因为它没有捕捉到大多数潜在的剂量限制性毒性。
有些I期临床试验将DLT评估期延长至两个周期,例如阿斯利康的度伐利尤单抗
(MEDI4736)
,在进行I期剂量爬坡试验时
(NCT01693562)
,Q2W给药方案的DLT评估期为28天,Q3W给药方案的DLT评估期为42天。
但是,如果DLT评估期设定为很长的时间,会大大延缓该I期试验的入组速度,整个研发进程也会受到很大的影响。
有文献建议I期试验剂量增减的决策不应推迟,仍应以第一个周期的数据为基础。然而,剂量增减以及II期推荐剂量应考虑到所有可用的信息,例如:PK和PD数据,整个试验中观察到的毒性,毒性的发生周期、持续时间、对试验药物和剂量强度的影响
(例如导致试验药物剂量暂停、永久停药、剂量调整等)
。
针对迟发毒性的问题,目前也有一些新的爬坡设计方法,例如Time-to-event BOIN设计。对此感兴趣的读者可以进一步查阅相关资料。
目前国内大多数创新药物,都是Fast-follow的产品,药物的安全性及耐受性数据都有同靶点或类似靶点的药物可以参考。这类产品在进行I期临床试验设计时,参考/借鉴其它方案往往也不会出现大的问题。
但是,如果研发的产品是真正的First in class 的产品,进行I期临床试验设计,还是需要深入考虑各种问题,尽量避免遗漏产品的重要安全性信号,才能更好地保证受试者的安全,同时更好地推进产品的研发进程。
参考文献(上下动查看更多)
1. Postel-Vinay S, Collette L, Paoletti X, Rizzo E, Massard C, Olmos D, et al. Towards new methods for the determination of dose limiting toxicities and the assessment of the recommended dose for further studies of molecularly targeted agents--dose-Limiting Toxicity and Toxicity Assessment Recommendation Group for Early Trials of Targeted therapies, an European Organisation for Research and Treatment of Cancer-led study. Eur J Cancer. England; 2014;50:2040–9.
2. Le Tourneau C, Razak ARA, Gan HK, Pop S, Diéras V, Tresca P, et al. Heterogeneity in the definition of dose-limiting toxicity in phase I cancer clinical trials of molecularly targeted agents: a review of the literature. Eur J Cancer. England; 2011;47:1468–75.
3. Eisenhauer, Elizabeth A., Christopher Twelves, and Marc Buyse, eds. Phase I cancer clinical trials: a practical guide. Oxford University Press, 2015.
4. Yap, Timothy A., Jordi Rodon, and David S. Hong, eds. Phase I Oncology Drug Development. Springer International Publishing, 2020.
5. Lutzky, Jose, et al. "A phase 1 study of MEDI4736, an anti–PD-L1 antibody, in patients with advanced solid tumors." (2014): 3001-3001.
6. Wong, Han Hsi, and Sarah Halford. "Dose-limiting toxicity and maximum tolerated dose: still fit for purpose?." The Lancet. Oncology 16.13 (2015): 1287-1288.













 个人中心
个人中心
 我是园区
我是园区




