近日,葛兰素史克(GSK)和Vir Biotechnology公司联合宣布,双方已经达成一项协议,扩展已有的研发合作,开发治疗流感和其它呼吸道病毒的创新疗法。在2020年双方已经达成合作共同开发针对冠状病毒的创新疗法。

流感仅在美国,每年就导致50万人住院和3.4万人死亡,其中75%是由于甲型流感(influenza A)导致的。由于流感病毒株每年都会有变化,目前的流感疫苗对季节性流感的防护效力并不稳定。65岁以上并且患有至少一种合并症的老年人因流感住院或死亡的风险更高,而且这一群体通常对目前疫苗的应答较低。
根据这一协议,GSK将获得Vir治疗流感的潜在“best-in-class”单克隆抗体疗法的独家研发权益,包括名为VIR-2482的肌肉注射在研单克隆抗体,用于甲型流感的通用预防性治疗。它已经完成了1期临床试验。在为期3年的合作期间,GSK有权获得用于预防或治疗流感的下一代抗体的研发权益。
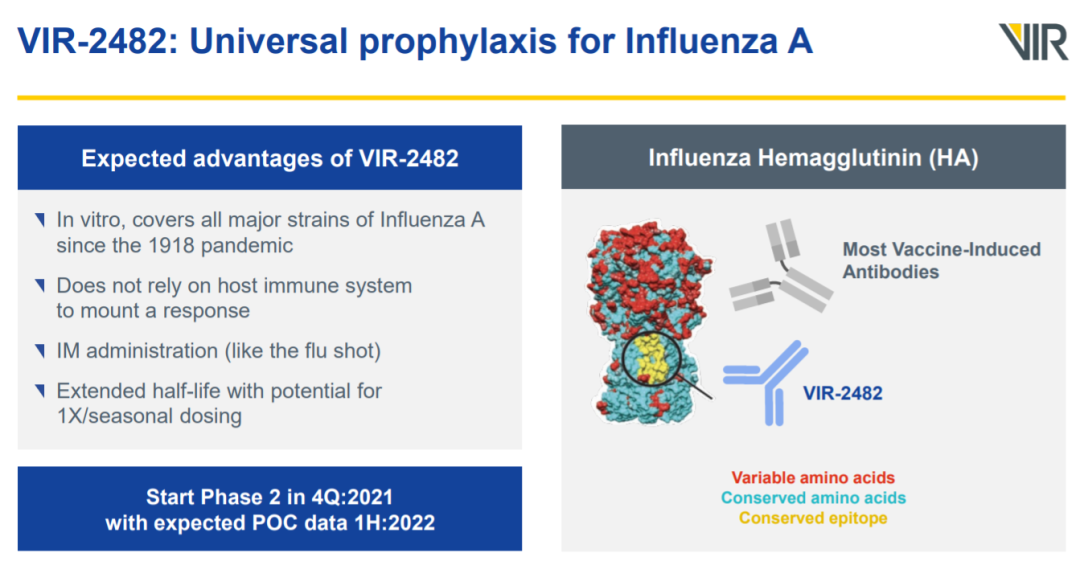
▲VIR-2482简介(图片来源:Vir Biotechnology官网)
此外,双方还将开展两个新研发项目:第一个项目是扩展已有的功能性基因组学合作,开发治疗其它呼吸道病毒的新靶点;第二个项目将利用Vir的抗体技术平台,开发靶向非流感病原体的3款中和单克隆抗体疗法。
GSK将支付2.25亿美元前期付款,并且将股权投资数目增加1.2亿美元。
日前,Seagen公司(前Seattle Genetics)和安斯泰来(Astellas Pharma)联合宣布,创新抗体偶联药物Padcev(enfortumab vedotin-ejfv)治疗局部晚期或转移性尿路上皮癌患者的3期临床试验结果在《新英格兰医学杂志》(NEJM)上发布。预定的中期分析显示,在接受过化疗以及PD-1/PD-L1抑制剂治疗的患者中,接受Padcev治疗的患者中位总生存期为12.9个月,比化疗对照组延长3.9个月(HR=0.70, 95% CI:0.56-0.89, p=0.001)。基于这一结果,两家公司将向FDA递交监管申请,寻求将加速批准转为完全批准。同时这一证据将支持Padcev在全球范围的监管申请。

在全球范围内,在2020年,全球范围内大约有58万人被诊断患有膀胱癌。尿路上皮癌占所有膀胱癌的90%,也可以出现在肾盂、输尿管和尿道。在接受含铂初始化疗失败之后,80%的晚期患者对PD-1或PD-L1抑制剂治疗不会产生应答。
Padcev是将抗nectin-4单克隆抗体与微管抑制剂偶联起来的抗体偶联药物。Nectin-4蛋白是在尿路上皮癌中高度表达的细胞粘附分子。基于缓解率数据,这款疗法在2019年12月获得美国FDA加速批准,治疗局部晚期或转移性尿路上皮癌患者。这些患者曾经接受过含铂化疗和PD-1/PD-L1抑制剂的治疗。
发布在NEJM的试验数据显示,在中位随访时间达到11个月时,Padcev与化疗相比,将患者死亡风险降低30%。

▲Padcev在3期临床试验中的总生存期数据(图片来源:参考资料[3])
而且Padcev也达到这一临床试验的多个次要终点。例如Padcev将患者疾病进展或死亡的风险降低38%,Padcev组中位无进展生存期为5.55个月,化疗组为3.71个月。Padcev组的确认总缓解率为40.6%,疾病控制率达到71.9%。
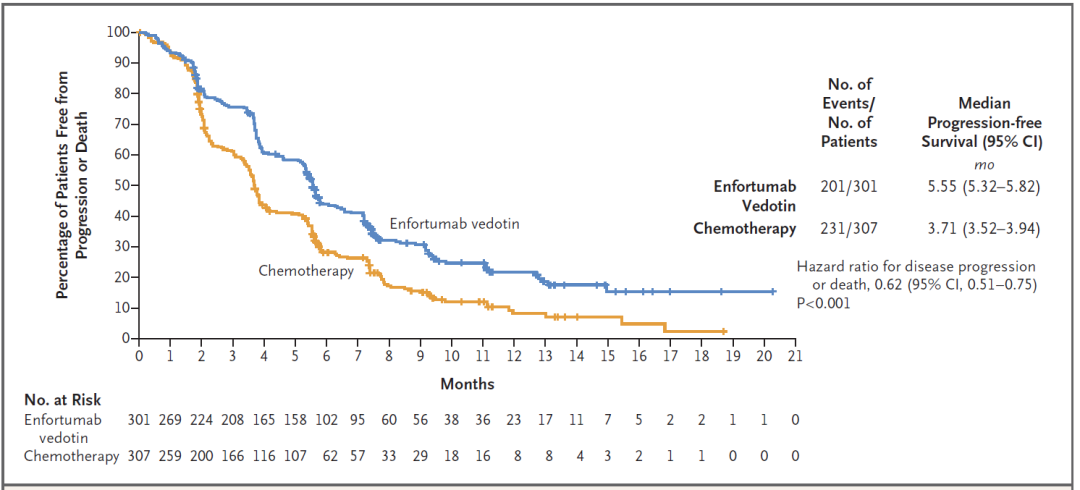
▲Padcev在3期临床试验中的无进展生存期数据(图片来源:参考资料[3])
安进(Amgen)公司近日宣布,美国FDA已授予该公司的KRAS G12C抑制剂sotorasib优先审评资格,用于治疗携带KRAS G12C突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者,他们至少接受过一种前期全身性治疗。美国FDA预计在今年8月16日之前做出回复。

NSCLC占所有肺癌的80%-85%,大多数患者(66%)在初次诊断时为晚期或转移性疾病。KRAS G12C是NSCLC中最常见的驱动突变之一。一线治疗失败的KRAS G12C突变NSCLC患者的选择有限,目前治疗的结局并不理想。这些患者二线治疗的缓解率约为9-18%,中位无进展生存期约为4个月。
安进开发的sotorasib是首个进入临床开发阶段的KRAS G12C抑制剂,目前正在广泛的临床项目中进行研究,在短短两年多的时间里,sotorasib临床项目也建立了深厚的临床数据集,已经在13种肿瘤类型的研究中用于治疗超过600名患者。它已经获得美国FDA授予的突破性疗法认定。在中国,安进和百济神州共同申报的sotorasib今年也拟纳入突破性治疗品种。
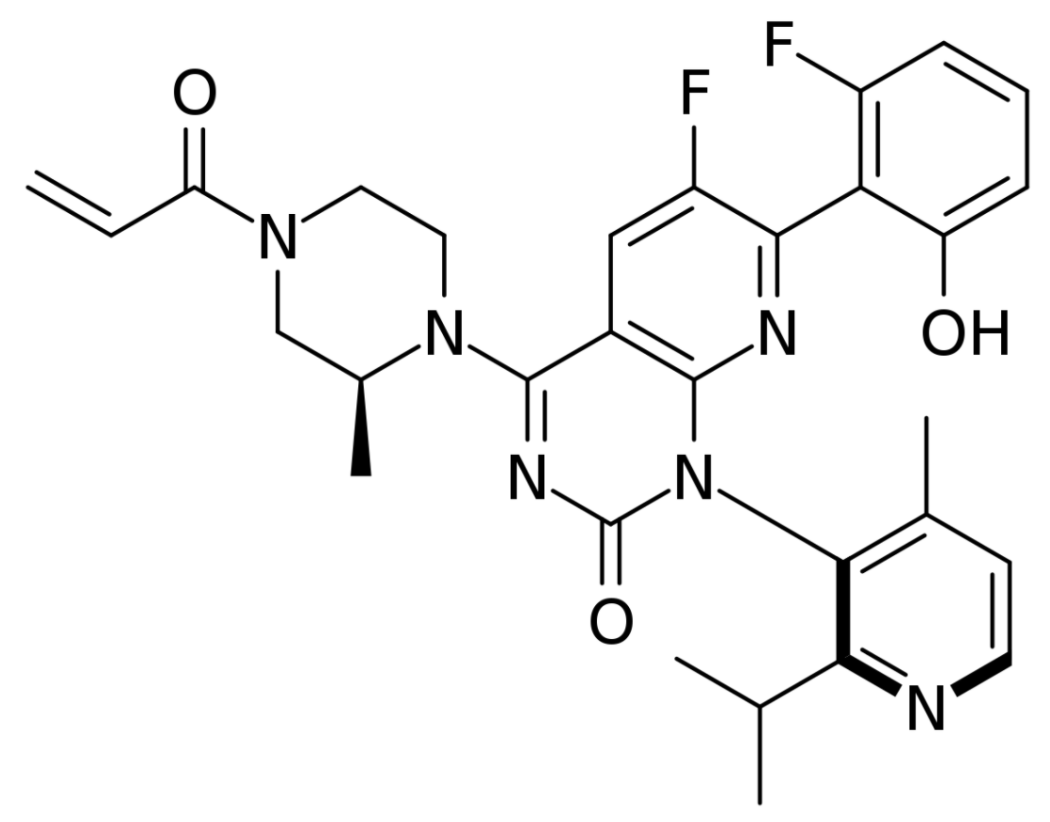
▲Sotorasib分子结构式(图片来源:User:Edgar181, Public domain, via Wikimedia Commons)
这一新药申请(NDA)是基于名为CodeBreaK 100的2期临床试验结果。在今年的世界肺癌大会(WCLC)上公布的结果显示,在中位随访时间为12.2个月时,sotorasib达到37.1%的确认客观缓解率(ORR)和80.6%的疾病控制率,其中包括3例完全缓解和43例部分缓解。中位缓解持续时间为10个月,中位无进展生存期为6.8个月。
这一申请目前在FDA的实时肿瘤学审评(RTOR)试点项目下接受审评。安进已经在去年12月向欧盟递交了监管申请,并且在FDA的Orbis试点项目下向澳大利亚、巴西、加拿大和英国的监管机构递交了上市申请。
日前,诺华公司(Novartis)宣布,该公司已经与比尔及梅琳达·盖茨基金会(Bill & Melinda Gates Foundation)达成协议。作为协议的一部分,盖茨基金会将提供资金支持开发一次性体内基因疗法,用于治愈镰刀型细胞贫血病(SCD)。这一项目将汇集诺华在药物开发和基因疗法方面的专长,和盖茨基金会将医疗保健扩展到资源不足国家的愿景,致力于解决SCD这一潜在致命遗传病。

SCD是一种遗传性血液病,由于编码血红蛋白β肽链的基因出现变异,导致血红蛋白功能异常。它影响全球上百万患者的生活,每年有30万新生儿患有这一疾病。虽然SCD的致病遗传机理已经被澄清,但是直到最近几年,生物医药界才获得通过纠正基因来治疗这一疾病的工具。
目前处于临床阶段的基因疗法或基因编辑疗法需要从患者体内取出细胞,在体外对这些细胞进行基因工程改造,然后再将改造后的细胞输回。虽然这一疗法近来展现出显著的疗效,但是制造这种基因疗法的设备通常在SCD最为广泛的地区并不存在,因此绝大多数患者无法获得这种可能改变他们生命的基因疗法。
诺华计划开发一种治疗SCD的体内(in vivo)基因疗法。它可能只需要一次性直接注射到患者体内,不需要在体外通过基因工程修改细胞,从而避免了许多和体外基因疗法相关的住院过程和专门的实验设备。为了促进研究,盖茨基金会将为诺华生物医学研究所(NIBR)提供资金,支持一支专门的研究团队在这一方向的研究。
日前在《新英格兰医学杂志》上发表的一项长期研究显示,由诺华(Novartis)公司开发的CAR-T疗法Kymriah在长期随访研究中表现出积极疗效。60%接受Kymriah治疗的B细胞淋巴瘤患者在接受治疗5年后仍然处于缓解期(remission)。

Kymriah是首个获得FDA批准的CAR-T疗法。它通过靶向B细胞表面的CD19抗原,让经过改造的CAR-T细胞消灭血液中的B淋巴细胞。在这项研究中,研究人员对接受Kymriah治疗的弥漫性大B细胞淋巴瘤(DLBCL)和复发/难治性滤泡性淋巴瘤患者进行了长期随访。在24名DLBCL患者中,46%的患者在5年后处于完全缓解。在14名复发/难治性滤泡性淋巴瘤患者中,71%在5年后仍处于完全缓解。

研究人员同时评估了CAR-T细胞在患者体内的持久性。他们发现在缓解期持续1年以上的患者中,50%的患者在5年后体内检测不到表达靶向CD19的嵌合抗原受体的转基因。而在18名在接受CAR-T细胞疗法治疗1年内出现复发的患者中,只有1名患者的转基因检测不到。这一结果意味着CAR-T细胞的丢失可能不是导致疗法耐药性的常见原因。
近日Immunocore宣布,美国FDA授予其创新T细胞受体(TCR)疗法tebentafusp(IMCgp100)突破性疗法认定,用于治疗不可切除性或转移性葡萄膜黑色素瘤(mUM)成人患者,这些患者为HLA-A*02:01阳性。新闻稿指出,如果获得批准,tebentafusp将是40年来治疗转移性葡萄膜黑色素瘤的首个新疗法。

Tebentafusp创新地将靶向肿瘤抗原的TCR与能够和CD3受体结合的免疫效应结构域(immune-effector domain)联合到一起。依照设计,该双特异性蛋白能引导和激活T细胞,让它们识别和杀死癌细胞。Tebentafusp特异性靶向gp100,它是在黑色素细胞和黑色素瘤中表达的抗原。
值得关注的是,该公司的相应技术能让TCR以高亲和力识别细胞内的癌症抗原,这有望突破现有抗体类药物的局限,将可识别的靶点数量从10%增加到90%。此外,基于现有的T细胞浸润人类肿瘤的机制,Immunocore也指出,其TCR技术有望用于治疗免疫学上的“冷肿瘤”,即突变率不高,传统上难以引起免疫系统注意的肿瘤。
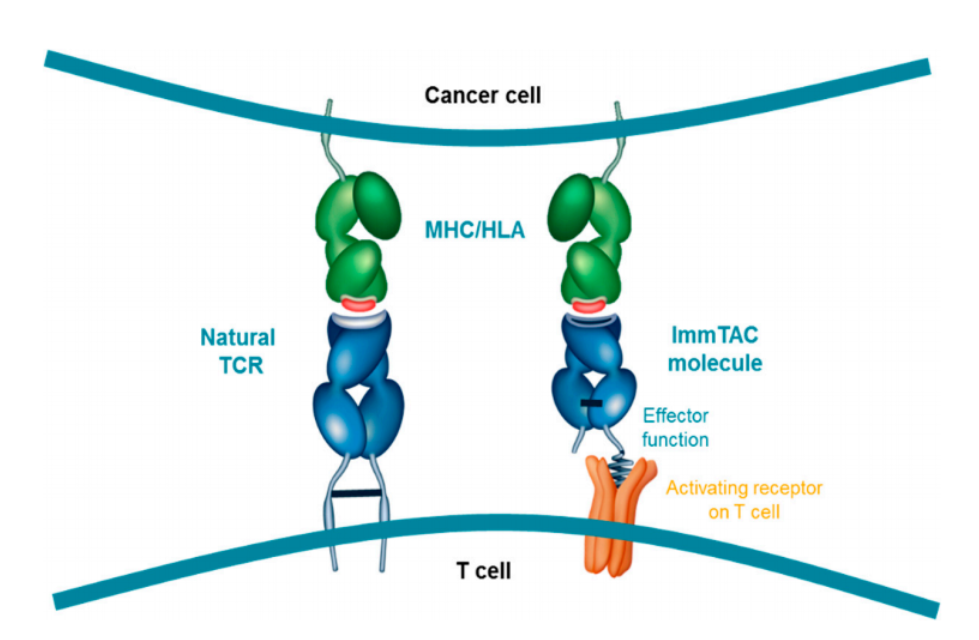
▲此类TCR疗法的设计,模拟了天然的TCR作用机制(图片来源:参考资料[8])
这一突破性疗法认定是基于在2020年11月公布的3期临床试验结果。中期分析显示,在治疗初治转移性葡萄膜黑色素瘤患者时,与研究人员选择的其他疗法相比(包括dacarbazine、ipilimumab或pembrolizumab),tebentafusp表现出显著生存获益。尽管目前数据尚未完全成熟,但tebentafusp组目前的一年生存率为73%,优于其他疗法组的58%。
注:本文旨在介绍医药健康研究,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料:




 个人中心
个人中心
 我是园区
我是园区




