由每日经济新闻联合药渡数据共同推出,旨在解读新药研发进展与趋势,剖析产品竞争力与市场前景,洞察医药资本脉络,见证医药产业高质量发展。

◎2月11日,CDE官网显示,信达生物靶向CD47/PD-L1的双抗药物IBI322临床申请获得受理。靶向CD47/PD-L1的双抗药物IBI322是真正意义上的潜在“First-in-Class”新药,但这款公司龙头产品出海遇挫,信达生物亟需一款明星药物来提振资本市场的信心。
◎开发免疫激动剂药物是目前抗癌研发领域的重要方向,目前海内外多家药企均有所布局。迈威生物的8MW2311此次为首次申报临床,属于热门靶点快速跟进的创新药,全球尚无同类改良型IL-2药物上市。《掘金创新药》研究员认为,迈威生物产品管线创新度较高,但距离其创新品种迈入商业化阶段还有很长一段路要走。
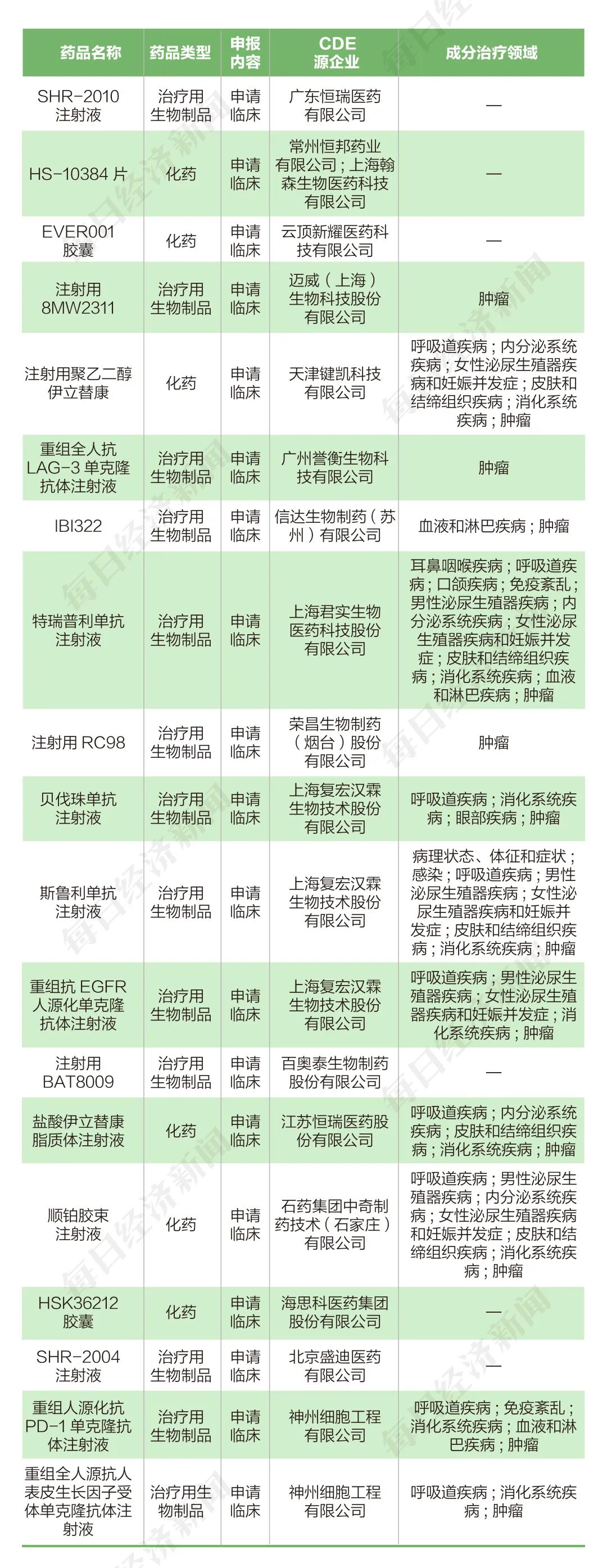
根据药渡数据,2022年2月7日至2022年2月20日,国家药品监督管理局药品审评中心(CDE)共收到14家上市公司(含上市公司控股公司)提交的19个化学新药、治疗用生物制品新药申请。


2022年2月7日至2022年2月20日期间,上市公司方面,复宏汉霖(02696.HK)和恒瑞医药(600276.SH)各申报3个临床申请,神州细胞(688520.SH)共申报2个临床申请,翰森制药(03692.HK)、云顶新耀(01952.HK)、迈威生物(688062.SH)、键凯科技(688356.SH)、誉衡药业(002437.SZ)、信达生物(01801.HK)、君实生物(688180.SH)、荣昌生物(09995.HK)、百奥泰(688177.SH)、石药集团(01093.HK)和海思科(002653.SZ)各申报1个临床申请。
1. 信达生物D47/PD-L1双抗临床申请再获受理,能否一扫出海遇挫阴霾?
2月11日,CDE官网显示,信达生物靶向CD47/PD-L1的双抗药物IBI322临床申请获得受理。
公开资料显示,IBI322是信达生物开发的一款潜在“First-in-Class”重组抗CD47/PD-L1双特异性抗体,此前已于2020年初分别在中国和美国获批临床,拟开发治疗实体瘤和血液肿瘤。公司方面表示,IBI322能够有效诱导吞噬肿瘤细胞及刺激T细胞活化,发挥抗肿瘤活性;IBI322更易亲和肿瘤组织,从而减少靶点对正常组织的毒性并延缓耐药的发生。
 行业洞察
据了解,CD47(重组全人源抗分化抗原簇47)蛋白是癌细胞上过度表达的免疫调节分子,与PD-1、PD-L1、CTLA-4等作用于T细胞的免疫检查点抑制剂不同,CD47主要通过与抑制性受体信号调节蛋白α(SIRPα)作用而抑制巨噬细胞的吞噬作用,并介导多种恶性肿瘤免疫逃逸机制。
行业洞察
据了解,CD47(重组全人源抗分化抗原簇47)蛋白是癌细胞上过度表达的免疫调节分子,与PD-1、PD-L1、CTLA-4等作用于T细胞的免疫检查点抑制剂不同,CD47主要通过与抑制性受体信号调节蛋白α(SIRPα)作用而抑制巨噬细胞的吞噬作用,并介导多种恶性肿瘤免疫逃逸机制。
公司称,临床前研究显示,IBI322可有效阻断SIRP-α与CD47结合,诱导巨噬细胞对CD47和PD-L1共表达的肿瘤细胞发挥吞噬作用,效用与抗CD47单抗相当。另一方面,IBI322可有效阻断PD-1与PD-L1结合,激活CD4+T淋巴细胞,效用与抗PD-L1单抗相当。
双特异性抗体通过识别并结合两个抗原靶点,可同时阻断两种信号通路,发挥出远超单抗的治疗效果,同时还能避免单一抗体潜在的副作用。双抗药物被认为是下一代抗体药物新星,市场潜力巨大,国内多个创新药企业均有布局。头豹研究院预测,中国双抗行业市场到2024年达到50亿元规模。
IBI322是信达生物第三款进入临床试验阶段的针对晚期恶性肿瘤治疗的双特异性抗体药物。药渡数据显示,从全球范围来看,靶向CD47/PD-L1的在研双抗药物共17款,其中有7款药物处于临床阶段,进展最快的药物处于临床II期。
 公司点评
虎年春节后的第一周,国内创新药行业最为关注的无疑是信达生物PD-1信迪利单抗闯关FDA遇挫。
2月11日,信达生物发布公告披露,FDA肿瘤药物咨询委员会(ODAC)以14:
1的投票结果,要求信达生物补充额外的临床试验,以消除目前产品“临床试验无国际多中心临
床研究、无头对头试验”两大不足。
目前,信达生物共有6款产品处在商业化阶段,其中五款为抗肿瘤药物,分别是信迪利单抗、贝伐珠单抗、利妥昔单抗、佩米替尼和奥雷巴替尼片,另外有一款适应证为自身免疫的阿达木单抗,上述6款商业化产品有望支撑公司短期内业绩增长。信迪利单抗是公司最重要的龙头产品,2021年上半年,信达生物实现总收入19.42亿元,同期信迪利单抗的销售收入超过14亿元。目前,信达生物尚未实现盈利,2018年到2020年,公司累计亏损近85亿元,但亏损已不断收窄。
一边是龙头产品出海遇挫,另一边是股价跌跌不休,2021年12月至今,信达生物股价已经腰斩。出海遇挫后,信达生物亟需一款明星药物来提振资本市场的信心。
公司点评
虎年春节后的第一周,国内创新药行业最为关注的无疑是信达生物PD-1信迪利单抗闯关FDA遇挫。
2月11日,信达生物发布公告披露,FDA肿瘤药物咨询委员会(ODAC)以14:
1的投票结果,要求信达生物补充额外的临床试验,以消除目前产品“临床试验无国际多中心临
床研究、无头对头试验”两大不足。
目前,信达生物共有6款产品处在商业化阶段,其中五款为抗肿瘤药物,分别是信迪利单抗、贝伐珠单抗、利妥昔单抗、佩米替尼和奥雷巴替尼片,另外有一款适应证为自身免疫的阿达木单抗,上述6款商业化产品有望支撑公司短期内业绩增长。信迪利单抗是公司最重要的龙头产品,2021年上半年,信达生物实现总收入19.42亿元,同期信迪利单抗的销售收入超过14亿元。目前,信达生物尚未实现盈利,2018年到2020年,公司累计亏损近85亿元,但亏损已不断收窄。
一边是龙头产品出海遇挫,另一边是股价跌跌不休,2021年12月至今,信达生物股价已经腰斩。出海遇挫后,信达生物亟需一款明星药物来提振资本市场的信心。
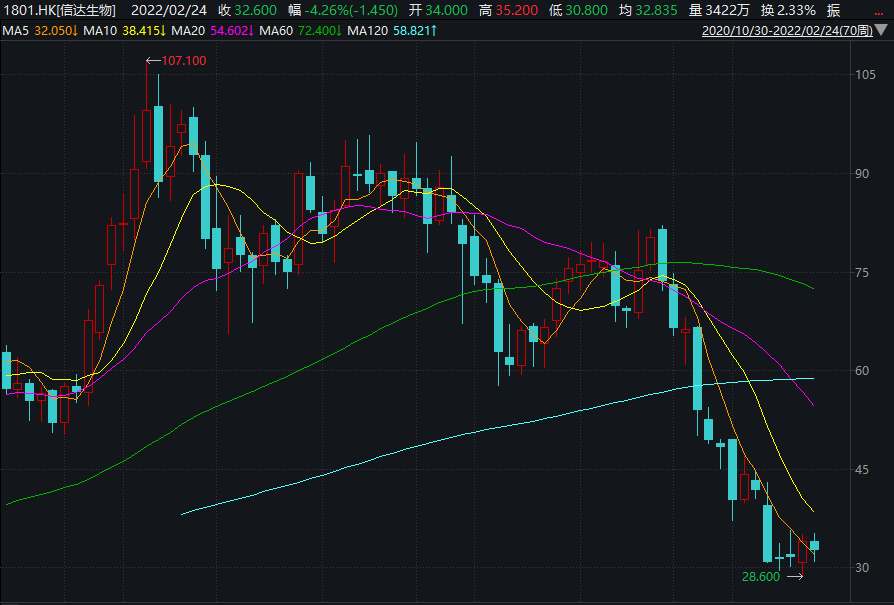
图片来源:Wind截图
此前ODAC公布的会议文件指出,信迪利单抗本次申报的适应证并没有解决美国临床未被满足的需求。在FDA已经批准了数款PD-(L)1药物上市,同时PD-(L)1研发竞争进入白热化的情况下,作为一款“me-too”类药物,信迪利单抗出海受阻也给国内创新药的出海之路敲响了警钟。市场分析人士认为,未来“me-too”类药物出海难度将加大,而“First-in-Class”药物仍有广阔的出海空间。
《掘金创新药》研究员认为,尽管信达生物目前尚未实现盈利,但一方面,信迪利单抗4项适应证进入医保目录,其适应症扩张和持续增长的销售表现一定程度上将缓解市场对其商业化进展的担忧;另一方面,从管线布局来看,信达生物构建了庞大的研发管线,覆盖肿瘤、自身免疫、心血管、眼病等领域,数十个新药品种已进入临床研究,其研发管线具有较大的竞争力和市场潜力。
另外,靶向CD47/PD-L1的双抗药物IBI322是真正意义上的潜在“First-in-Class”新药,目前正在中美两国分别进行临床试验,有了此次信迪利单抗出海受阻的经验,公司或将会更加坚定地对“First-in-Class”新药加大研发投入。
《掘金创新药》研究员试图就IBI322的相关问题采访信达生物,公司方面回复称,IBI322尚处于临床早期阶段,很多临床数据还未发布,目前不便接受采访。
2. 迈威生物免疫激动剂8MW2311临床申请获得受理 公司目前尚无商业化产品获批
2月15日,科创板新军迈威生物发布公告称,公司的免疫激动剂注射用8MW2311(以下简称8MW2311)临床试验申请获得受理。
据悉,8MW2311是一种聚乙二醇偶联人白介素-2免疫激动剂,拟用于治疗晚期恶性肿瘤。8MW2311注射入体内后,可刺激下游转录因子STAT5磷酸化,有效激发杀伤性T淋巴细胞CD8+T细胞的增殖,从而发挥药效。公司称,临床前研究结果显示,8MW2311在肿瘤组织中富集并具有偏好地激活CD8+T细胞的药理作用,在多种肿瘤模型中显示出持续有效的抑瘤作用,并且与免疫检查点药物(如抗PD-1抗体)联用能表现出显著性增强的协同抑瘤效果。
 行业洞察
在经过化疗、分子靶向治疗之后,如今肿瘤治疗的新药研发已迈入了免疫治疗时代。对于肿瘤免疫治疗,一般来说有两种思路,一是通过药物松开被癌细胞故意死死拽住的刹车,让抗癌的免疫细胞顺利杀死癌细胞,现如今研发竞争火热的PD-1、PD-L1、CTLA-4等抗体药物均属于这一类。
另一种思路就是通过药物给抗癌的免疫细胞“加油”,让免疫细胞更有力地杀死癌细胞,此次迈威生物申报临床的免疫激动剂8MW2311即属于这一类。根据公司招股书,8MW2311靶点为PEG-IL2,属于融合蛋白类药物,拟申请适应证为黑色素瘤、肾细胞癌等。
开发免疫激动剂药物是目前抗癌研发领域的重要方向,目前海内外多家药企均有所布局。迈威生物的8MW2311此次为首次申报临床,属于热门靶点快速跟进的创新药,全球尚无同类改良型IL-2药物上市。
行业洞察
在经过化疗、分子靶向治疗之后,如今肿瘤治疗的新药研发已迈入了免疫治疗时代。对于肿瘤免疫治疗,一般来说有两种思路,一是通过药物松开被癌细胞故意死死拽住的刹车,让抗癌的免疫细胞顺利杀死癌细胞,现如今研发竞争火热的PD-1、PD-L1、CTLA-4等抗体药物均属于这一类。
另一种思路就是通过药物给抗癌的免疫细胞“加油”,让免疫细胞更有力地杀死癌细胞,此次迈威生物申报临床的免疫激动剂8MW2311即属于这一类。根据公司招股书,8MW2311靶点为PEG-IL2,属于融合蛋白类药物,拟申请适应证为黑色素瘤、肾细胞癌等。
开发免疫激动剂药物是目前抗癌研发领域的重要方向,目前海内外多家药企均有所布局。迈威生物的8MW2311此次为首次申报临床,属于热门靶点快速跟进的创新药,全球尚无同类改良型IL-2药物上市。
 公司点评
公司点评
迈威生物是科创板新军,公司于今年1月刚刚在科创板挂牌上市。迈威生物也是一家年轻的创新型生物制药企业,专注于抗体药物的研发。公司称,将坚持以临床亟需的生物类似药为先导,以快速跟进和同类首创为主导的研发及商业化策略。
在管线布局上,迈威生物覆盖自身免疫、肿瘤、代谢、眼科、感染等治疗领域,现有15个在研品种处于不同研发阶段,其中3个品种已提交上市申请。根据招股书,迈威生物与君实生物合作开发的9MW0113的上市申请已获受理,目标适应证为类风湿关节炎等,预计2022年第一季度获得上市批准;公司自主研发的9MW0311和9MW0321的上市申请也获得了受理,目标适应证分别为骨折高风险的女性绝经后骨质疏松症和预防实体瘤骨转移患者发生骨相关事件,预计2023年获得上市批准。
值得注意的是,上述三款申报上市的产品均为生物类似药,存在无法获得适应证外推导致的商业价值降低风险。同时,上述三款生物类似药上市后将面临激烈的市场竞争和带量采购带来的价格压力。
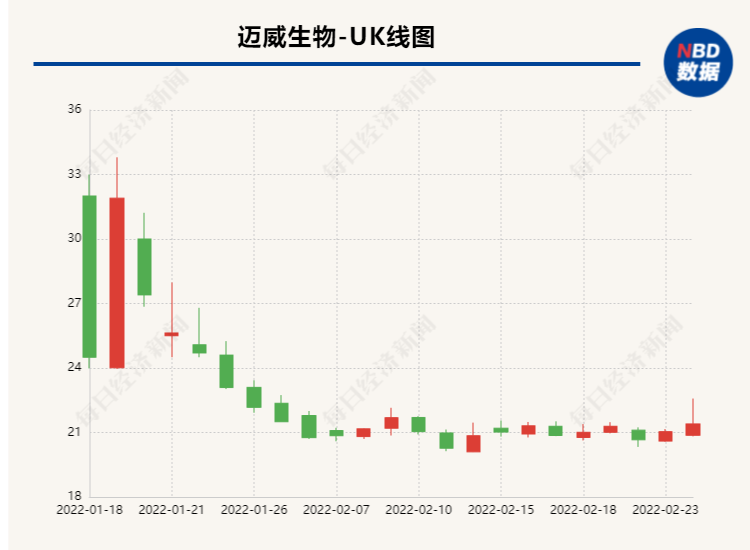
目前,迈威生物尚无商业化产品面世,未产生产品销售收入。根据公司此前发布的2021年业绩预告,公司预计2021年归母净利润为-6.66亿元到-7.82亿元。2018年到2020年,公司累计亏损约18亿元。上市一个月以来,公司股价较发行价累计跌去约四成。
《掘金创新药》研究员认为,迈威生物15个在研品种中,有11个创新品种和4个生物类似药,产品管线创新度较高,但距离其创新品种迈入商业化阶段还有很长一段路要走。
在相同适应证已有数款产品获批上市的情况下,生物类似药9MW0113上市后将面临激烈的市场竞争,其上市后的销售情况还未可知,能否解“燃眉之急”还有待观察。
《掘金创新药》研究员试图就8MW2311的相关事宜采访迈威生物,并按要求将采访函发送至指定邮箱,截至发稿尚未获得回复。








 行业洞察
行业洞察
 公司点评
公司点评

 行业洞察
行业洞察
 公司点评
公司点评




 个人中心
个人中心
 我是园区
我是园区




