

正文目录
1. 前言
2. 靶向治疗药物与CDx
3.1 细胞程序性死亡配体(PD-L1)
3.2 肿瘤突变负荷(TMB)
3.3 微卫星不稳定(MSI)/ 基因错配修复功能(MMR)

FDA批准的靶向药物
FDA Approved Targeted Therapies
靶向药物CDx与生物标记物
CDx and Corresponding Biomarkers

乳腺癌(Breast Cancer)
20-25%的乳腺癌患者都过量表达人表皮生长因子受体2(HER2),它能使肿瘤细胞增长。目前已有很多针对HER2阳性的肿瘤靶向药物和CDx试剂。

非小细胞肺癌(NSCLC)
靶向抑制EGFR的药物也可以减缓肺癌的发展,尤其在EGFR有某些基因突变的情况下。同时,具有ALK和ROS基因突变的肺癌也有相应靶向药物,也有一些场合医生会使用血管生成抑制剂。

Note: 带*标记为Panel类产品
结直肠癌(Colorectal Cancer)
结直肠癌患者通常过量表达表皮生长因子受体(EGFR),同时EGFR不具有KRAS突变,靶向抑制EGFR的药物可以减缓肿瘤发展。另外,抑制血管生长因子(VEGF)的药物也可以通过阻断新血管生成,减缓肿瘤的发展。

Note: 带*标记为Panel类产品
慢性粒细胞白血病(CML)
几乎所有的慢性粒细胞白血病都是由BCR-ABL基因的形成驱动。这种基因导致BCR-ABL蛋白酶的形成,使正常骨髓粒细胞像癌细胞一样不受控制地增生。

黑色素瘤(Melanoma)
几乎一半的黑色素瘤在BRAF基因中有突变。BRAF是一种非常有效的药物靶点,因此FDA批准了不少BRAF抑制类的靶向药。同时,BRAF靶向药对没有BRAF突变的肿瘤也有明显的副作用。

Note: 带*标记为Panel类产品
细胞程序性死亡配体(PD-L1)
Programmed Death-ligand 1
免疫组化检测(IHC)
免疫组织化学检测(IHC)是病理诊断中常用的一种检测手段,它是利用带标记的特异性抗体(或抗原)与组织内抗原(或抗体)进行特异性结合并通过化学反应使标记抗体显色,以此来对组织细胞内抗原进行定位、定性及定量的研究。
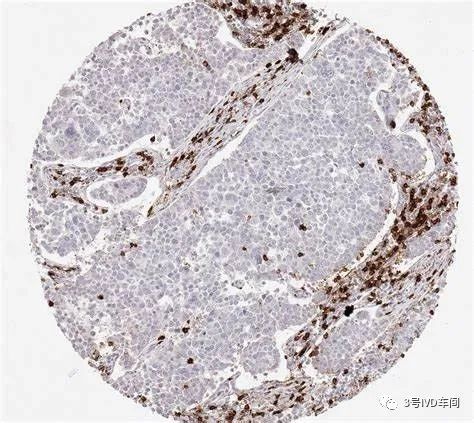
PD-L1的检测
PD-L1检测的CDx产品均为免疫组化平台的检测。免疫组化(IHC)基于细胞蛋白水平的检测,其染色的判读方法和结果的判读标准差异较大:判读方法主要依据PD-L1表达于肿瘤细胞(TC)还是肿瘤浸润免疫细胞(IC);判读标准也有两种,其一,肿瘤比例评分(Tumor Proportion Score–TPS),即着色阳性的肿瘤细胞数占所有肿瘤细胞数的百分比;其二,联合阳性评分(Combined Positive Score - CPS)即着色的肿瘤细胞、淋巴细胞及巨噬细胞数之和占全部存活肿瘤细胞的百分比,再乘以100。
FDA获批CDx产品
PD-L1表达量的检测主要依赖于4种单克隆抗体,其中3种已有FDA批准的相应CDx产品:

Note: Ventana PD-L1 sp-26检测试剂盒获NMPA批准用于尿路上皮癌。
肿瘤突变负荷(TMB)
Tumor Mutational Burden
TMB指肿瘤细胞基因组中,所评估基因的编码区发生置换和插入和(或)失性突变(体细胞突变)的总数,通常按每兆碱基(Mb)中的突变数计算。TMB水平高的肿瘤,代表着肿瘤细胞中能被免疫系统识别的肿瘤新抗原(Neoantigen)数量可能越多,从而免疫系统能对肿瘤细胞产生有效杀伤,实现好的治疗效果。
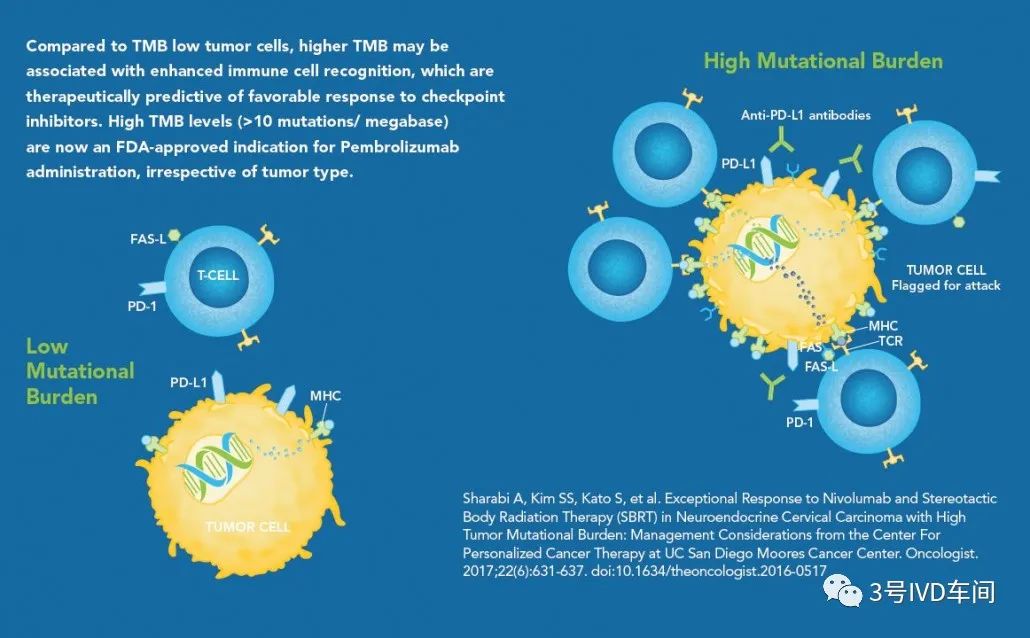
TMB的检测及CDx产品
ctDNA,全基因组测序、全外显子测序和选择性基因测序。TMB检测成本高、普及率低、有效cut-off值不确定、组织样本和血液样本TMB结果一致性及缺乏前瞻性研究等,在一定程度上均限制了其广泛的临床应用。(尚未有FDA的单独获批产品,仅包含在panel类产品中)

其他可配合检测的治疗药物 (尚未纳入指南)
O药 Opdivo (nivolumab); Tecentriq (atezolizumab); Yervoy (ipilimumab)
微卫星不稳定(MSI)
基因错配修复功能(MMR)
Microsatelite Instability / DNA Mismatch Repair
人类错配修复基因(MMR基因)经转录翻译后可表达相应的错配修复蛋白,如果任一MMR蛋白表达缺失(dMMR),可造成细胞的错配修复功能缺陷,则对DNA复制过程中的碱基错配丧失修复功能,从而造成累积,进一步导致MSI的发生。约15%的结直肠癌是由MSI途径引发的。
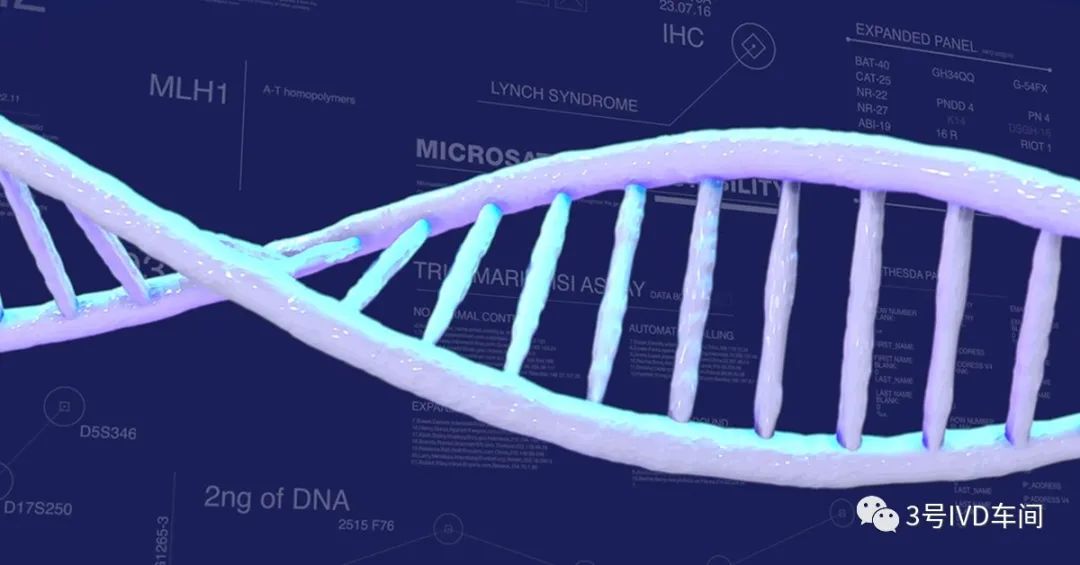
MSI分为MSI-H, MSI-L, MS-S;MMR分为dMMR(基因错配修复功能缺陷),pMMR(基因错配修复功能完整)。dMMR等同于MSI-H,pMMR等同于MSI-L或MS-S。
高度微卫星不稳定(MSI-H)的肿瘤多为高TMB,两者存在一定相关性。反之,高TMB的患者不一定是MSI-H。
MSI/MMR的检测及CDx产品
MMR的IHC检测:MMR的IHC检测包括对4个错配修复蛋白表达的检测,只要四个蛋白里任何一个蛋白的表达是缺失的(阴性),肿瘤就属于dMMR;如果四个蛋白全部表达阳性,肿瘤是pMMR。(尚未有FDA单独获批的产品)
MSI的PCR/NGS检测:同时需要肿瘤细胞和对应正常细胞,对肿瘤细胞DNA中5个(美国NCI规定的标准位点,也有11个等)微卫星位点的长短进行检测,与对应的正常细胞DNA进行比较。如果其中有两个或两个以上的位点是不稳定的,为MSI-H,一个位点不稳定为MSI-L,5个位点都一样为MSS。检测11个位点时,>=30%位点不稳定为MSI-H,0-30%为MSI-L,全部稳定为MSS。(尚未有FDA单独获批的产品,仅包括在panel类产品中)

其他可配合检测的治疗药物 (尚未纳入指南)
K药 Keytruda (pembrolizumab); O药 Opdivo (nivolumab); Yervoy (ipilimumab)

REFERENCES
“List of Cleared or Approved Companion Diagnostic Devices (In Vitro and Imaging Tools)”, fda.gov
“Understanding Targeted Therapy”, cancer.net
Foundationone CDx Technical Specifications
《中国非小细胞肺癌PD-L1表达检测临床病理专家共识》
“免疫治疗时代,你必须知道的MSI/dMMR” 肿瘤咨询
“List of Cleared or Approved Companion Diagnostic Devices (In Vitro and Imaging Tools)”, fda.gov
目前已有500+行业精英加入基因俱乐部
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()




 个人中心
个人中心
 我是园区
我是园区




