
传统认为,乳酸是糖酵解途径产生的代谢废物和能量代谢中的“丑小鸭”【1】,但这种观念正在逐步发生改变。越来越多的研究表明乳酸是重要的能量燃料、合成砌块和信号分子【2-4】,是具有多种关键作用的代谢“明星”,在生理和病理过程中发挥重要作用。然而,乳酸代谢呈现剧烈的动态变化和复杂的空间分布,传统的生化方法难以实现活细胞和在体水平的动态追踪。因此,迫切需要建立一种面向活细胞和在体的、高时空分辨的乳酸代谢监测新技术。
2022年10月28日,华东理工大学药学院、生物反应器工程国家重点实验室赵玉政教授、杨弋教授以及上海市第四人民医院王从容主任合作在Cell Metabolism发表题为 Ultrasensitive sensors reveal the spatiotemporal landscape of lactate metabolism in physiology and disease 的技术长文,报道一种高性能的乳酸监测成像新技术,实现了在活细胞、亚细胞和在体水平对乳酸代谢的原位、实时、定量动态追踪,并在乳酸空间分布、调控网络、药物筛选、临床诊断方面取得了重要突破。


遗传编码的荧光探针是解决细胞代谢高时空动态监测这一技术难题的神兵利器。聚焦细胞代谢监测国际前沿领域,研究团队已针对细胞内关键辅酶NADH、NAD+、NADPH以及乳酸等,研发了系列高性能代谢荧光探针以及“高通量”与“全景式”活细胞代谢监测分析方法,系列研究成果发表在Nature Methods(2017)、Nature Metabolism(2021)、Nature Protocols(2018;2016)、Cell Metabolism(2022;2019;2015;2011)、Developmental Cell(2020)、Cell Reports(2022)、Science Advances(2021)、Blood(2020)等学术期刊(图1)。研究团队基于理性设计和定向进化等策略,获得高特异、高响应、超灵敏的乳酸荧光探针FiLa,并且在监测分析的分辨率、准确度、便捷性方面具有显著优势,可谓是能量代谢分析技术领域的重磅研究。

图1:研发系列高性能遗传编码代谢物探针
利用FiLa探针,作者首先绘制了亚细胞乳酸代谢图谱。现有的教科书告诉我们,乳酸作为糖酵解产物,定位于细胞浆。上世纪90年代末研究者发现线粒体中存在乳酸脱氢酶,由此线粒体内是否存在乳酸这一问题引发了一系列研究和激烈讨论。然而,这些研究基本都是采用分离细胞线粒体进行乳酸检测、或者测量乳酸代谢酶进行间接推断,结论莫衷一是,几十年悬而未决的问题争议至今。近来报道的组蛋白乳酸化修饰【5】暗示了乳酸存在于细胞核的可能性,使得乳酸分布的真实面貌更加扑朔迷离,引人注目。本研究发现,细胞核内乳酸水平与细胞浆相近,而线粒体内乳酸水平远高于细胞浆和细胞核(图2)。为了验证这一发现,作者对三种细胞分离了完整的线粒体,对在线粒体表达FiLa探针的细胞进行了超分辨成像、生化分离研究、以及利用多种方法进行乳酸检测,系统地验证了线粒体基质内富集了高浓度乳酸这一出人意料的结论。这一发现解决了该领域争议了几十年的重要科学问题,同时首次使人们观察到,人体细胞内乳酸具有更丰富的代谢命运,这对肿瘤代谢和免疫代谢等有重要的启示作用,打开了乳酸代谢研究的新窗口。

图2:哺乳动物细胞线粒体高度富集乳酸
接下来,作者基于FiLa探针建立了活细胞水平药物高通量筛选方法,研究乳酸的代谢调控机制。通过测定2种癌细胞 (非小肺癌和宫颈癌细胞)、4个亚细胞区间(细胞外环境、细胞浆、细胞核和线粒体)在2种营养状态(葡萄糖充足与缺乏)和24种靶向10条重要代谢途径的小分子化合物或药物作用下的乳酸水平(图3),揭示了乳酸是感知细胞多种代谢活动的重要枢纽。研究还发现细胞外乳酸与细胞内乳酸水平时常表现出不一致的情况,显示了胞外酸化推断糖酵解水平的局限性。
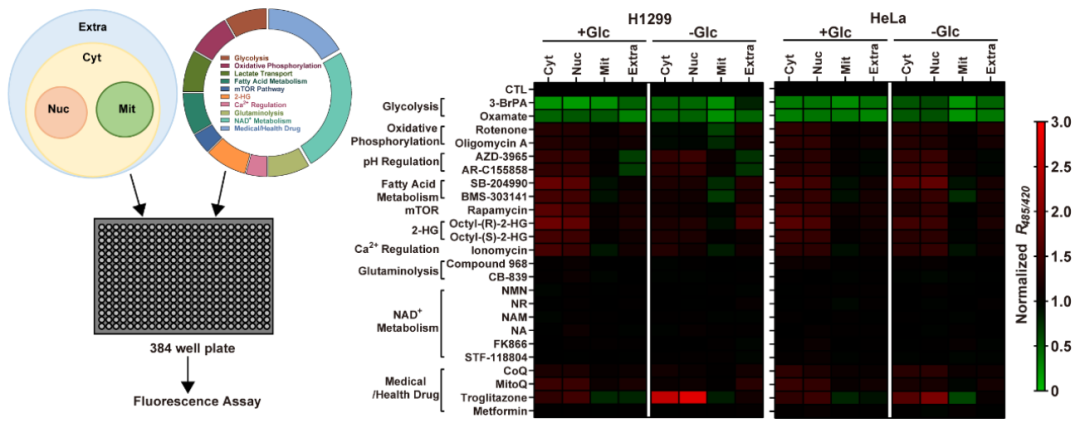
图3:亚细胞乳酸代谢图谱揭示乳酸是感知各种代谢活动的关键枢纽
糖尿病人存在乳酸代谢异常,作者首先针对I型糖尿病(T1DM)和II型糖尿病(T2DM)小鼠开展了活体动物成像研究,实时监测了T1DM小鼠在胰岛素治疗下的乳酸动态变化。接着,作者进一步建立了基于FiLa探针的临床体液样本即时检测技术,分别测定了成人隐匿性自身免疫性糖尿病(I型糖尿病的一类分型)、II型糖尿病、母系遗传性糖尿病伴耳聋(MIDD)患者以及健康人的体液乳酸水平,发现MIDD糖尿病人尿液中乳酸水平升高(图4)。由于MIDD患者的发病年龄和临床表现缺乏显著的区分度,经常被误诊为I型或II型糖尿病,本研究发现尿液乳酸显著升高可能作为该疾病的潜在筛查标志物,为临床诊断提供了重要依据。
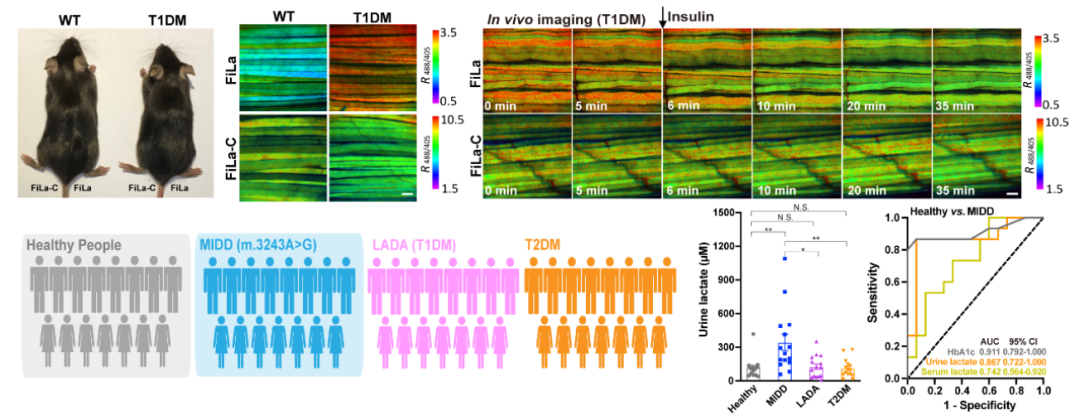
图4:活体乳酸代谢成像新技术与MIDD糖尿病诊断筛查
总的来说,该研究不但发展了具有广泛应用前景的乳酸代谢监测技术,解决了关于乳酸代谢的长期争议,引出了一系列前沿研究课题,并且为生命现象解析、疾病机制探索、创新药物发现、疾病快速诊断等生命医学领域提供了创新性的研究工具,助力人民生命健康。
本论文主要由华东理工大学博士后李写、王傲雪、邹叶君、李婷,博士研究生黄立、陈伟才,以及上海市第六人民医院的张宜男副研究员、华东师范大学的徐凌燕研究员等人共同完成。华东理工大学赵玉政教授、杨弋教授和上海市第四人民医院的王从容主任为共同通讯作者。
制版人:十一
参考文献
1. Rabinowitz, J.D. & Enerback, S. Lactate: the ugly duckling of energy metabolism. Nature Metabolism 2, 566-571 (2020).
2. Faubert, B., et al. Lactate metabolism in human lung tumors. Cell 171, 358-371 (2017).
3. Hui, S., et al. Glucose feeds the TCA cycle via circulating lactate. Nature 551, 115-118 (2017).
4. Zhang, W., et al. Lactate is a natural suppressor of RLR signaling by targeting MAVS. Cell 178, 176-189 (2019).
5. Zhang, D., et al. Metabolic regulation of gene expression by histone lactylation. Nature 574, 575-580 (2019).




转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区





