
“我希望自己的研究能直接造福肌肉病患者。目前,相关专利已授权给一家生物公司,因此下一步会用于发展肌肉病的临床试验。我现在带领一个团队在研究和优化肌肉干细胞移植疗法,以期推动临床试验。”说这话的是孙从姗。这位本科毕业于中国海洋大学、博士毕业于英国南安普顿大学的南京女孩,前不久刚在 Cell Stem Cell(IF 24.6)发了一篇关于肌肉干细胞的新论文 [1]。

图 | 孙从姗(来源:孙从姗)
她表示,该成果可直接推动肌肉疾病干细胞治疗的发展和成熟。现阶段,很多遗传性肌肉疾病都没有特效药。本次研究证明,只需提取一些病人自身的体细胞,再进行体外转化和基因修正,移植到病人体内之后,即可变出健康的肌肉干细胞,从而对组织进行修复,以实现治愈效果。
此前,曾有一支团队发现,移植小鼠多能干细胞衍生的成肌祖细胞,可以成为局部肌肉干细胞,但是尚未有人报道过人类的人多能干细胞衍生的成肌祖细胞(human pluripotent stem cell derived myogenic progenitor cells,hPSC-MPC)具有相同功能。而在该研究中她发现,hPSC-MPC 能在移植之后,可以成为局部肌肉干细胞。

(来源:Cell Stem Cell)
在治疗肌肉疾病上,让干细胞移植法向临床发展跨出一大步

本次发现也让干细胞移植治疗肌肉疾病,向临床发展跨了一大步。
具体来说:
其一,课题组运用多能干细胞去制造肌原性祖细胞,该方法为将来运用病人自身体细胞去制造诱导性多能干细胞、并转化成可移植的肌原性祖细胞提供了可靠基础。运用病人自体细胞,可以很好地避免细胞移植带来的免疫排斥。
其二,该研究证明了移植的肌原性祖细胞可以变成肌肉干细胞。此发现的重大意义在于,肌肉干细胞本身就有再生功能。所以,一旦移植的细胞能变成肌肉干细胞,它们可以不断地再生。这样,只需移植一次,干细胞就能在病人体内不断再生,从而达到完全替代病变组织的可能。并且在时效性上,该方法也比非干细胞移植具有优势。
其三,课题组使用单细胞 RNA 测序去分析移植的细胞。运用这种比较新的技术,为以后相似研究提供了平台。
近日,相关论文以《人类多能干细胞衍生的肌原性祖细胞在植入后成熟为静止的卫星细胞》(Human pluripotent stem cell-derived myogenic progenitors undergo maturation to quiescent satellite cells upon engraftment)为题发表 Cell Stem Cell 上,孙从姗担任第一作者,李嘉桑(Gabsang Lee)和凯瑟琳·瓦格纳(Kathryn Wagner)担任共同通讯作者。

图 | 相关论文(来源:Cell Stem Cell)
审稿人评价称,这是一个令人兴奋的故事,它建立在大量诱导性多能干细胞衍生的、肌肉始祖细胞/成肌细胞研究的基础上,表明了移植的肌肉始祖细胞一旦嵌入生态位,就可以作为肌肉干细胞(又称肌卫星细胞)发挥作用。
虽然这不是第一篇证明移植的肌肉始祖细胞可以重新填充生态位的论文,但它确实在概念上取得了重要进展:即生态位环境能促进移植的肌肉始祖细胞、向胎儿和成人基因表达程序的发育进程。
这一点很重要,因为之前的工作表明,诱导性多能干细胞的所有体外肌肉分化系统,都会导致形成胚胎样肌肉始祖细胞/成肌细胞,这非常有可能不适合人体移植。该研究还表明,移植的肌肉始祖细胞可以修复重复损伤模型、以及二次移植模型中的肌肉,毫无疑问这将推进该领域的进步。
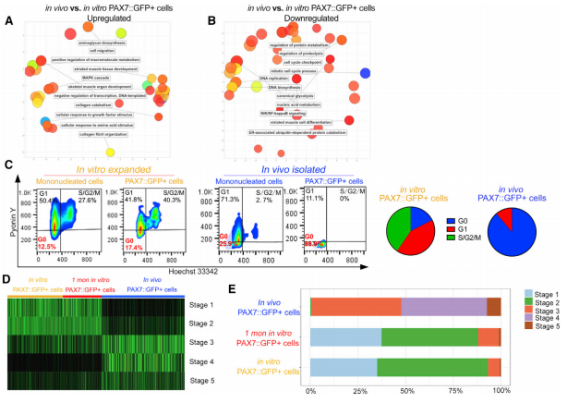
据介绍,该研究的背景在于,在脊椎动物的肌发生过程中,Pax3 和 Pax7 是肌原性祖细胞中两个重要转录因子。肌原性祖细胞能分化表达 Pax7 的肌肉干细胞,又被称为肌卫星细胞,其定位于出生后肌纤维的基底板内。
在出生后的健康肌肉中,肌卫星细胞保持静息状态。一旦肌肉损伤,它就会被激活,分化产生成肌细胞,后者可进行增殖、并修复受损的肌纤维。
(来源:Cell Stem Cell)
与此同时,部分卫星细胞的子代细胞能维持 Pax7 的表达并自我更新,从而重建肌卫星细胞池。鉴于卫星细胞具有长期的自我更新特性,因此作为一种细胞治疗手段,肌卫星细胞移植比成肌细胞扩增更有优势。
据介绍,人诱导多能干细胞,可以从患者中获得。作为一种极具前景的自体细胞替代疗法,它能避免潜在的免疫反应和细胞排斥。最近,也有相关研究报道了在小鼠和人类中通过多能干细胞生成肌原细胞谱的方法。
由人诱导多能干细胞生成的细胞,包含不同种类的肌原性祖细胞、以及表达肌原蛋白的成肌细胞和分化的肌管细胞。其中,不同种类的肌原性祖细胞可以通过转录因子 PAX3/PAX7、MYOD 的表达水平来鉴定。
最近也有研究表明,在免疫缺陷小鼠中,PAX3/PAX7 阳性的人诱导多能干细胞来源的肌原性祖细胞,在植入后能够被分化。然而,人诱导多能干细胞来源的肌原性祖细胞,是否能保持静止并填补卫星细胞巢,从而提供长期再生能力并改善肌肉功能,对于这一点学界尚不清楚。
由于人多能干细胞(hPSC,Human pluripotent stem cell)来源的肌原性祖细胞移植,是治疗各种肌肉退行性疾病的一种很有前途的方法。而孙从姗使用肌原性祖细胞特异性荧光报告系统(PAX7::GFP),证明了人多能干细胞来源的肌原性祖细胞,可以促进局部损伤模型小鼠、以及抗肌萎缩蛋白缺陷模型小鼠中肌纤维的再生。
她还证明了当 PAX7::GFP MPCs 移植到再生肌原纤维的基底层后,其保持静息状态,但在再损伤模型小鼠和抗肌萎缩蛋白缺陷模型小鼠中能促进肌纤维再生。
将 PAX7::GFPMPCs 细胞移植到体内后,它们会经历一个成熟过程,表面的分子特征得以重塑,最终就像胎儿晚期的肌原性祖细胞、或成人时期的卫星细胞一样。
这些在体内成熟的 PAX7:GFPMPCs 保留了一种细胞自主再生的能力,并可以在次级受体小鼠中重新扩增,为未来基于人多能干细胞的肌肉疾病细胞治疗提供了原理证明。

(来源:Cell Stem Cell)
可推动肌肉疾病干细胞治疗的发展和成熟

孙从姗表示,项目的初始阶段是研究优化 hPSC-MPC 移植的方法、以及如何分离出移植的细胞。在这一阶段,她耗时 1 年左右去找到合适的技术。
之后两年,她和同事做了很多种单细胞生物信息学的分析,包括单细胞 RNA 测序、单细胞实时荧光定量 PCR(Quantitative Real-time PCR)等。以上步骤旨在探索移植的细胞在小鼠体内(代替人体)的环境会怎样变化。
当发现移植的细胞可转化成自体肌肉干细胞之后,孙从姗又花费两年,做了很多动物实验去反复验证结果,去证实移植的细胞确实变成了自体干细胞,而且是具有再生功能的干细胞。
她表示,“最难忘的就是分离出移植一个月之后的 hPSC-MPC 的时刻。因为是用的小鼠模型,人的细胞移植之后会有很大一部分死亡。所以,留下的细胞数量会很少。这个是我们这个领域研究的瓶颈,我们花了一年的时间摸索条件。如果摸索不出条件会放弃该项目,所以当找到条件而且分离出细胞的时候,我们是非常兴奋的。后续,我将优化体外细胞转化方法和移植方法。”
概括来说,本次研究使用单细胞策略,探索了人类人诱导多能干细胞来源的肌原性祖细胞的命运,向人多能干细胞来源的肌原性祖细胞细胞治疗迈出了一步。
本研究产生的“可移植”的定向细胞谱具有一个明显的优势,即不像之前的研究那样依赖异位基因过表达,例如用 HoxB4 基因诱导造血细胞定向分化,以及用 PAX3/7 基因诱导人类肌原细胞定向分化。
在这项研究中,初级和次级肌原性祖细胞种群之间的重建率有非常显著的差异,这意味着以下两种可能:
(1)在卫星细胞巢和静止的肌原性祖细胞中存在“学习交流”;(2)在“预定”或“预先成熟的”细胞中,再生重建能力具有选择性优势,而这将是孙从姗后续要研究的问题。
在中国海洋大学读本科期间,对干细胞生物学产生浓厚兴趣

据介绍,孙从姗是江苏南京人,和很多生医领域博士毕业生不同的是,在完成英国伦敦国王学院和美国约翰霍普金斯大学两站博后研究之后,她没有继续留在高校做科研,而是加入了企业。

(来源:孙从姗)
其本科就读于中国海洋大学生物技术专业。本科期间接触到细胞生物学,这门课程的授课老师樊廷俊,给其之后的学习留下了很深的影响。从他的课堂上,孙从姗开始对细胞、特别是干细胞生物学产生了浓厚的兴趣。从那时起,她立志要从事干细胞相关研究。
本科之后,她在英国南安普顿大学读博,主攻方向为胚胎干细胞,三年时间拿到学位,期间发表了两篇一作论文,其中一篇发在期刊 Development 上。后来,进行了两站博后研究。
第一站博士后,是在英国伦敦国王学院完成,当时她研究了 Hippo 信号在肌肉干细胞中的作用,并以一作身份在 Stem Cells 上发表论文。
第二站博士后,她来到美国约翰霍普金斯大学,结合之前的工作,开始了肌肉干细胞移植的研究。这时,她的另一个研究方向是建立肌肉疾病药物筛选平台,相关论文已于 2 年前发表。
目前,她职于一家药物公司。其表示:“由于生物行业发展迅速,相比十年前,生物公司的数量和质量有了质的改变,相比于学界,业界现在的机会多了很多。更重要的是,业界的研究更与临床相关。在工作方式上,业界也更加注重团队合作,更加分工明确,更加高效快速。这些对于我来说都更加有吸引力。”
-End-

支持:Bao
参考:
1、CongshanSun et al, Human pluripotent stem cell-derived myogenic progenitors undergo maturation to quiescent satellite cells upon engraftment, Cell Stem Cell (2022). DOI: 10.1016/j.stem.2022.03.004




 个人中心
个人中心
 我是园区
我是园区





