丙肝迎来上市新药,东阳光依米他韦全球领跑
收藏
关键词:
上市新药药
资讯来源:药渡 + 订阅账号
所属行业:化学药制剂 + 订阅行业
发布时间:
2020-08-04

近日,国家药品监督管理局通过优先审评审批程序批准歌礼生物科技(杭州)有限公司1类创新药盐酸拉维达韦片(商品名为新力莱
®
)上市,联合利托那韦强化的达诺瑞韦钠片和利巴韦林,用于治疗初治的基因1b型慢性丙型肝炎病毒感染的非肝硬化成人患者,不得作为单药治疗。
盐酸拉维达韦(Ravidasvir hydrochloride)是歌礼的第二个慢性丙肝候选药物,是一种同类最佳、针对丙肝NS5A抑制剂,具有高耐药屏障、高应答率、高耐受性及具有泛基因型的特点。在中国已经完成的II/ III期临床试验结果显示,经过12周治疗,RDV/DNV治疗方案在基因1型非肝硬化患者中治愈率(SVR12)达99%,且针对基线发生NS5A耐药突变的患者,100%实现SVR12。
拉维达韦和达诺瑞韦均获国家十三五“重大新药创制”科技专项立项支持。2014年,歌礼从Presidio公司获得了拉维达韦在大中华地区的独家权益。Presidio是一家处于临床阶段的制药公司。
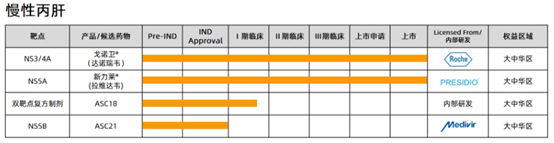
“非常高兴,歌礼全口服丙肝治疗方案获批上市后可以惠及广大丙肝患者。作为一家创新研发驱动型生物科技公司,我们同时也在努力攻克乙肝临床治愈的难题,比如我们正在开发全球首创(first-in-class)的免疫疗法——可皮下注射的PD-L1抗体,就是乙肝领域布局的在研管线之一。”歌礼创始人、董事长兼首席执行官吴劲梓博士说,“正在全球肆虐的新冠疫情、刚刚过去的世界肝炎日,都在提示我们面对重大公共卫生安全挑战,任何国家都难以独善其身,加强抗病毒药物的研究与开发对于民众健康、对于公共卫生体系意义重大。歌礼将继续夯实一体化抗病毒平台的研发实力,积极拓展前沿性、原创性的国际合作,为构筑全球健康安全屏障贡献自己的力量。”
在中国的II/III期临床试验中,RDV/DNV方案对309名HCV基因型1患者的治愈率(SVR12)为99%,比目前中国的主要治疗方案(治疗时间48至72周)要有效得多。
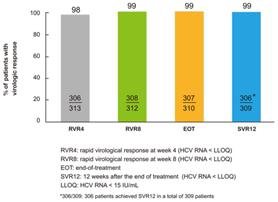
图2. 临床试验的病毒学应答(RVR4,RVR8,EOT和SVR12)
2. 对基线NS5A耐药性突变的HCV患者非常有效
在中国,19%的HCV患者携带基线NS5A耐药性突变。RDV/DNV方案对具有基线NS5A耐药性突变的患者表现出100%的治愈率(SVR12)。之前的产品的治愈率(SVR12)仅为20%。
RDV/SOF方案针对基因型1a患者的治愈率(SVR12)为99%,基因型3患者的治愈率(SVR12)为97%。
RDV/SOF方案针对肝硬化患者的治愈率(SVR12)为96%。
RDV/SOF方案针对HCV/HIV合并感染患者的治愈率(SVR12)为97%。
6. 针对基因1至6的泛基因型HCV具有抗病毒活性
两项RDV/SOF方案的III期临床试验表明,针对基因型1、2、3和6的总治愈率(SVR12)达97%,针对基因型4的治愈率(SVR12)为95%。
RDV/DNV方案的疗程为12周,明显短于当前主要方案的治疗时间,48至72周。较短的治疗时间将增加治疗的依从性并改善患者的耐受性。
RDV/DNV方案安全且耐受良好,没有与治疗有关的严重不良事件。除了贫血和高尿酸血症,RDV/DNV治疗组和安慰剂组的不良事件发生率相似。RDV/DNV治疗组中较高的贫血发生率可能与利巴韦林有关。
据世界卫生组织统计,全球HCV的感染率约为3%,估计约1.8亿人感染了HCV,每年新发丙型肝炎病例约3.5万例。据卫计委公布的数据显示,最近10年来我国丙肝病毒感染报告病例数呈逐年上升趋势,从2006年的70681例,急速增长到2012年的201622例,虽在之后稍微稳定在20万出头,但总趋势仍不乐观。
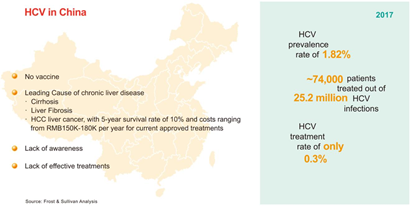
过去治疗丙肝的标准方法是聚乙二醇化的干扰素α(PEG-IFN α)与广谱抗病毒药利巴韦林(RBV)联用。虽然这方法毒性大周期长,但是治疗效果不错,HCV-1a型丙肝持续病毒应答率(SVR)大于70%。目前在我国等很多亚洲国家该疗法仍然是主要的治疗手段。
近年来默沙东、艾伯维、吉利德和BMS等公司相继开发出抗丙肝新药和新的治疗组合,取得了惊人的疗效,使得丙型肝炎这一疾病测定被人类攻克。
随着HCV NS3/4A蛋白酶抑制剂、NS5A抑制剂和NS5B聚合酶抑制剂的开发,不但丙肝治愈成为可能,而且排除干扰素和利巴韦林的治疗方案减少了对诸多禁忌症。
NS5A是HCV病毒非结构蛋白,其功能并没有明确,已知其是病毒生活周期所必需,病毒复制对其抑制高度敏感(体外抗病毒活性超强),被认为和病毒复制复合物形成和病毒与宿主互作有关。
经查询药渡数据库,截止发稿(2020年8月)全球有13款靶向NS5A的在研药物,其中中国1类有6款。
目前处于NS5A抑制剂第一梯队的是由广东东阳光研发的Yimitasvir Phosphate(磷酸依米他韦)。磷酸依米他韦获国家十二五新药创制重大专项资助,于2014年11月临床获批。在美国,该药物已经开启了评估磷酸依米他韦在慢性丙肝患者中的有效性和安全性的临床III期研究。2019年9月13日国家药品监督管理局承办了东阳光药关于本品的NDA申请。
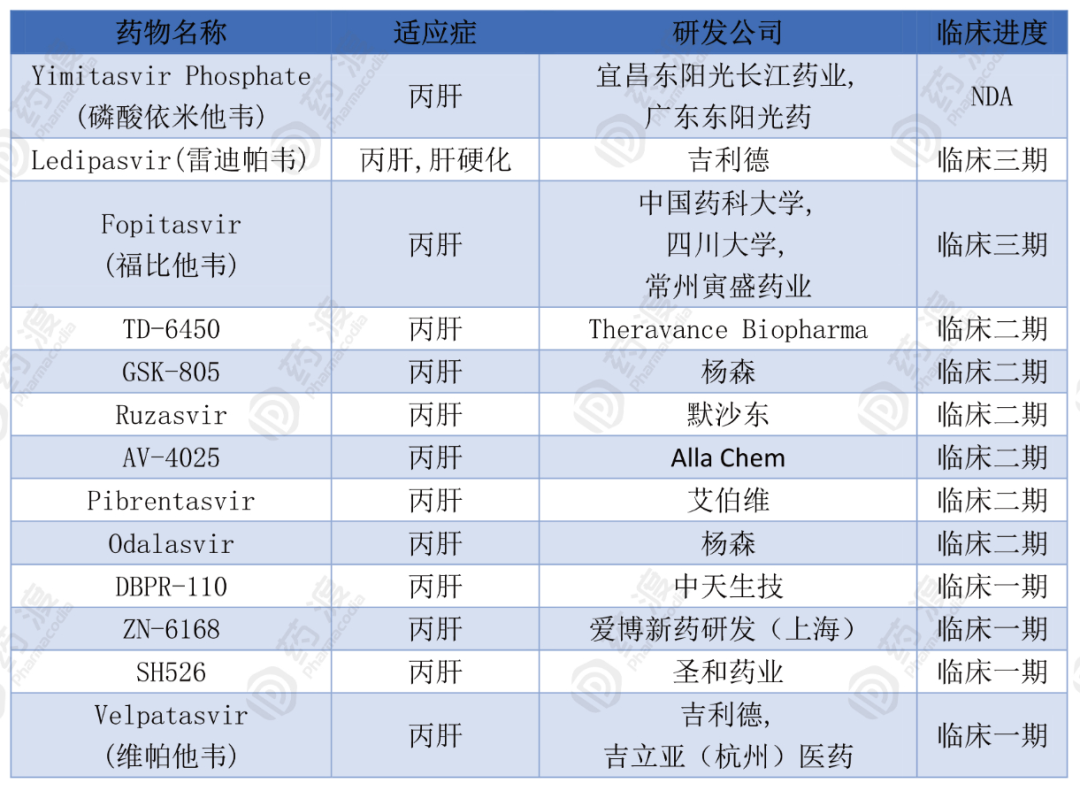
另外,由常州寅盛药业、四川大学和中国药科大学联合研发的福比他韦目前处于临床三期,用于治疗丙肝。该化合物获得“十二五”国家“重大新药创制”科技重大专项经费支持,属于特殊审评品种。福比他韦是一个新型HCV NS5A 抑制剂,其主要作用机制是通过抑制NS5A 蛋白阻止HCV 的复制从而达到治疗慢性丙型肝炎的作用。
圣和药业的SH526拟用于治疗丙肝,于2017年11月获得国内临床试验批件,目前处于临床一期。
盐酸拉维达韦是歌礼制药的第二款抗HCV药物,其疗效优于第一款抗HCV药物Danoprevir Sodium(达诺瑞韦钠)。达诺瑞韦钠2018年的全球销售额接近1.1亿美元,盐酸拉维达韦将与达诺瑞韦钠瓜分市场,拭目以待。
盐酸拉维达韦是最新一代NS5A抑制剂,具有高耐药屏障、高应答率、高耐受性及具有泛基因型的特点,为患者带来了新的治疗选择。
全球NS5A抑制剂研发竞争激烈,赛道拥挤,储备力量雄厚。杨森、吉利德等制药巨头均有HCV布局。东阳光的Yimitasvir Phosphate处于第一梯队,为国人争光。多个新化合物进入临床阶段,处于临床二期的有6款,临床一期的有4款。全球13款NS5A抑制剂中中国一类占据6款,占据半壁江山。












 个人中心
个人中心
 我是园区
我是园区




