据 Insight 数据库统计,本周(2 月 12 日-2 月 18 日)全球共有 44 款创新药(含改良新)研发进度推进到了新阶段,其中 2 款获批上市,2 款申报上市,4 款获批临床,9 款申报临床。
下文中,Insight 将分别摘取国内外部分重点项目做介绍。
国内部分,本周共有 48 款创新药(含改良新)研发进度推进到了新阶段,其中 1 款获批上市,3 款申报上市,5 款首次获批临床,12 款申报临床。
本周国内首次启动临床的 15 款创新药(含改良新)
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
2 月 15 日,据 NMPA 官网显示,柯菲平医药申报的 1 类创新药盐酸凯普拉生片获批上市,适用于十二指肠溃疡和反流性食管炎的治疗。盐酸凯普拉生为国产首款钾离子竞争性酸阻滞剂(P-CAB)。
盐酸凯普拉生是一种新型钾离子竞争性酸阻滞剂,通过与 H+-K+-ATP 酶上的 K+ 结合位点结合,抑制胃酸分泌。
2022 年 9 月,复星医药与柯菲平医药签署许可协议,双方将联合开发并由复星医药产业独家商业化盐酸凯普拉生,合作领域包括盐酸凯普拉生口服制剂和普通注射剂的所有可用适应症,双方将在全球范围内开展合作。
根据许可协议,在中国境内(不包括港澳台地区,下同),柯菲平医药作为合作产品的上市许可持有人,复星医药产业享有独家商业化权利,包括市场推广、经销等。
在中国境内以外的区域,复星医药产业作为合作产品的上市许可持有人,享有独家产品权利,包括但不限于临床研究、注册、商业化、再授权等。
来自:
Insight 数据库网页版
(http
://db.dxy.cn/v5/home/)
从抑酸机制上,H008 克服了目前临床上应用最广泛的质子泵抑制剂(PPI)药物的诸多缺陷,如:起效慢、抑酸不稳定、基因多态性导致个体差异大、须在餐前半小时服药等;和同类 P-CAB 药物相比,H008 在靶器官胃组织分布更多且持久,在肾脏等其他器官分布少。
H008 口服后迅速起效,且可强效持久抑酸,安全性好。此前,柯菲平层曾公布两项多中心随机双盲对照的 III 期临床研究均达到所有终点,每日一次口服 20 mg 的 H008 片,6 周内经内镜检查十二指肠溃疡愈合的受试者比例为 94.44%;8 周内经内镜检查反流性食管炎愈合的受试者的比例为 95.80%。
据柯菲平官方资料,H008 立项于 2014 年,2018 年在中国进入临床研究阶段,2021 年完成十二指肠溃疡和反流性食管炎两项 III 期临床研究后递交了 NDA 申请,并于今日
获批上市。
柯菲平同时也在美国开发这款创新药,2020 年已获得美国 FDA 的临床许可,目前正开展 I 期临床研究。
除口服制剂外,盐酸凯普拉生注射剂已于 2022 年 5 月获国家药监局批准在中国境内开展 I 期临床研究。
1、治疗早期阿尔茨海默病,卫材「仑卡奈单抗」拟纳入优先审评
2 月 17 日,CDE 官网显示,卫材 Aβ 抗体仑卡奈单抗上市申请(受理号:JXSS2200039/40)拟纳入优先审评,用于治疗早期阿尔茨海默病。公示信息如下:
仑卡奈单抗能选择性地结合并清除可溶的、具有神经毒性的 Aβ聚集体(原纤维)。
因此,仑卡奈单抗将会对 AD 的病理生理学产生影响,并减缓疾病的进展。
Clarity AD 研究显示,仑卡奈单抗的治疗达到了主要终点和所有关键的次要终点,结果具有显著统计学意义。
2022 年 11 月,Clarity AD 研究的结果在 2022 年阿尔茨海默病临床试验(CTAD)会议上公布,并同时发表在世界著名的同行评审医学杂志《新英格兰医学杂志》上。
仑卡奈单抗于 2023 年 1 月 6 日获得美国食品和药物管理局(FDA)加速批准。
卫材在同一天提交了一份补充生物制品许可申请(sBLA),以支持转为传统批准。仑卡奈单抗在欧洲的上市许可申请(MAA)已于 2023 年 1 月 9 日向欧洲药品管理局(EMA)提交。同时,卫材于 2022 年 12 月向中国国家药品监督管理局(NMPA)提交上市申请并获得受理。
仑卡奈单抗已在各监管机构提交上市申请,并率先在美国获批
截图来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
卫材和渤健曾经在 2014 年 3 月达成针对阿尔茨海默病新药的研发合作,2017 年卫材行使了协议中的选择权,获得 Aducanumab。
2022 年 3 月,在 Aducanumab 的商业失败之后,两家企业宣布修订了合作协议,卫材从分享 Aducanumab 的全球损益修改为根据其净销售额获取分级特许权使用费,而对 Lecanemab 的合作在全球范围内则继续保持不变。卫材拥有其最终决策权,继续担任 Lecanemab 全球开发和监管提交的领导者,两家公司共同实现商业化推广。基于对 Lecanemab 的看好,渤健商业生产的 Lecanemab 供应协议从 5 年延长至 10 年。
2、康哲药业:亚甲蓝肠溶缓释片中国注册上市许可申请已获受理
2 月 15 日,康哲药业宣布,其创新专利药亚甲蓝肠溶缓释片注册上市许可申请已于获得中国国家药品监督管理局(NMPA)受理。
亚甲蓝肠溶缓释片为一种口服的诊断药物,适用于在接受筛查或监测结肠镜检查的成年患者中增强结直肠病变的可视化,可显著提高非息肉样结直肠病变检出率。
2022 年 12 月 14 日,康哲药业宣布亚甲蓝肠溶缓释片中国 III 期临床试验取得积极临床结果。研究由首都医科大学附属北京友谊医院牵头,在全国 22 家中心开展,共随机入组 1802 例受试者,试验组和对照组分别为 897 例和 905 例。其中,亚甲蓝肠溶缓释片组 872 例和对照剂组 879 例进入 FAS 集(FAS:全分析集)。
主要研究终点非息肉样结直肠病变检出率(至少发现一处组织学证实的非息肉样结直肠病变的受试者比例)结果显示,试验组(施予产品)为 51.0%,对照组(施予安慰剂)为 41.2%,两组差异具有统计学意义(P<0.0001),且假阳性控制良好。
此外,亚甲蓝肠溶缓释片已于 2020 年 8 月被欧洲药品管理局(EMA)批准以 Lumeblue™ 的商品名在欧盟商业化。
2 月 17 日
,据 CDE 官网显示,
罗氏玛巴洛沙韦干混悬剂拟纳入优先审评。玛巴洛沙韦片剂 2021 年 4 月在国内获批,而干混悬剂新剂型在 11 月 2
2 日国内申报上市(受理号:
JXHS2200111
),本次拟优先审评的原因为:儿童用药新剂型。
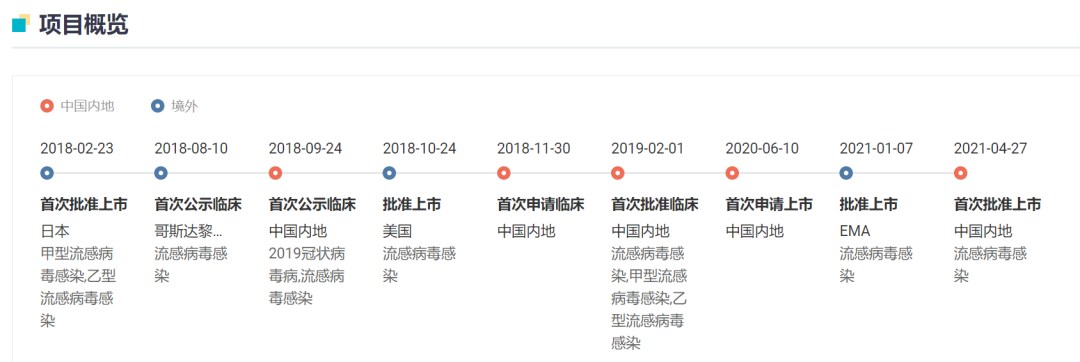
玛巴洛沙韦是一款抗流感新药,该药最初由日本药企盐野义开发。罗氏在 2016 年与盐野义达成了合作协议,共同负责该药在日本和台湾地区之外的研发工作,其中,罗氏拥有除日本和中国台湾以外地区的商业推广权利。
来自:Insight 数据库(http://db.dxy.cn/v5/home/)
2018 年 2 月,玛巴洛沙韦片(商品名:Xofluza)率先在日本获批,用于治疗 A 型和 B 型流感病毒株感染所致流感;2018 年 10 月 ,又获 FDA 批准用于治疗年龄在 12 岁及以上人群的急性、单纯性流感;2021 年 4 月,获 NMPA 批准在中国上市,商品名为速福达。
Xofluza 是一种具有全新的抗流感作用机制、单剂量口服药物
,该药属于 Cap 依赖型核酸内切酶抑制剂,旨在抑制流感病毒中的 CAP 帽子结构依赖性内切核酸酶,而该酶对于流感病毒的复制必不可少。
目前广泛使用的抗流感口服用药为神经氨酸酶抑制剂类抗病毒药物(奥司他韦),需要每日服用两次,连续服用 5 天。而全新作用机制的玛巴洛沙韦(Xofluza)可以直接抑制病毒复制,患者在全病程只需服用一次,就能在 24 小时内停止病毒排毒。
此外,Xofluza 还可以针对禽流感病毒 H5N1 和 H7N9 的抗达菲(Tamiflu)抗性病毒株,快速杀灭病
毒
。
相比于片剂,本次申报的口服混悬剂或可为儿童及吞咽困难的患者提供更方便的治疗。口服混悬剂于 2020 年 11 月获 FDA 批准上市。
罗氏披露的双盲、随机、多中心 III 期 MiniSTONE-2 研究
(登记号:NCT03629184)
数据表明玛巴洛沙韦口服混悬剂可有效缓解 1~12 岁流感儿童患者的症状。
1、荣昌生物:针对 NSCLC,HER2 ADC 联合吡咯替尼 II 期临床获批
2 月 14 日,荣昌生物宣布其在研 HER2 ADC 维迪西妥单抗联合马来酸吡咯替尼片治疗存在 HER2 基因突变的局部晚期或转移性非小细胞肺癌患者的 Ⅰb/Ⅱ 期临床研究正式获 CDE 批准(受理号:CXSL2200559)。
这是荣昌生物在维迪西妥单抗的联合用药方面又迈出了一步。
事实上,荣昌生物早已在尿路上皮癌领域中
探索了 RC48 与 PD-1 联用的疗效。
此前,在2022 ASCO 大会上披露了 RC48-C014(登记号:NCT04264936)研究数据,
结果显示,联合 PD-1 治疗尿路上皮癌患者无论在治疗线数、HER2 和 PD-L1 表达状态的情况下,患者均能从中获益。
在 mUC 患者中,cORR 为 71.8%。
随着 HER2 或 PD-L1 的表达增加,ORR 值升高。
在 Ib/II 期试验中,初治 mUC 患者的 cORR 为 73.9%(17/23)。
来自:
Insight 数据库网页版
(http
://db.dxy.cn/v5/home/)
基于此,在最新版《中国临床肿瘤学会(CSCO)尿路上皮癌诊疗指南(2022)》中,已经维迪西妥单抗联合特瑞普利单抗的一线疗法,新增进入Ⅲ 级推荐且覆盖 UC 全人群治疗。
与此同时,该联合疗法首次进入二线 Ⅲ 级推荐。
此外,针对一线 mUC 患者,荣昌生物也已在去年 4 月启动了一项 RC48 联合特瑞普利单抗对比含铂标准化疗的 3 期临床研究(登记号:NCT05302284/CTR20220348)。
在海外,荣昌合作者
Seagen 也正在开展一项 RC48 单药治疗或与 K 药联用治疗
尿路上皮癌的 II 期临床试验(登记号:NCT04879329),计划入组 332 名受试者,目前正在招募中,试验预计于 2026 年 3 月完成。
除
尿路上皮癌适应症之外,维迪西妥单抗联合 PD-1 也在开展针对胃癌的新辅助疗法。
2021 年 12 月启动的 RC48-C018 研究(登记号:NCT05113459 )是一项 II 期临床试验,联合信迪利单抗和卡培他滨用于胃及胃食管交界处腺癌的新辅助疗法,预计今年 12 月完成试验主要指标。
2、
维立志博:MUC16/CD3 双抗 LBL-033 获批临床
2 月 16 日,南京维立志博生物科技有限公司宣布,其自主研发、拥有全球知识产权的 1 类新药抗 MUC16 和 CD3 双特异抗体注射用 LBL-033 的临床试验申请已获得临床默认许可,是截至目前国内首家申报临床的同靶点 CD3 双抗。
PD-(L)1 免疫疗法的诞生已经为肿瘤患者带来了显著临床获益,然而众所周知的事,在不同类型的肿瘤中,对 PD-1/PD-L1 抗体治疗应答的患者仅有 20%~30% 左右,并且部分对 PD-1/PD-L1 抗体应答的患者最终疾病进展,仍旧存在着巨大的未被满足的临床需求。
对 PD-1 不应答可能原因包括:缺乏肿瘤特异抗原递呈,缺少肿瘤特异的 T 细胞浸润,抑制免疫的肿瘤微环境等等。而 CD3 双特异抗体可以介导 T 细胞不依赖于 MHC-TCR 识别肿瘤细胞,并产生靶向性的杀伤,是一种新型的抗肿瘤抗体形式。
MUC16
(Mucin16,粘蛋白 16)
属于粘蛋白家族的一种,是一种高度糖基化的跨膜蛋白,在卵巢癌等多种恶性肿瘤细胞表面高度表达,并与生长因子相互作用,调节其下游信号通路,诱导肿瘤的发生和发展。MUC16 胞外区经过蛋白剪切成为游离的形式 CA125,是一种肿瘤生物标志物,与肿瘤患者的不良预后相关。
LBL-033 双抗作为一种 T细胞连接器,同时靶向表达 MUC16的肿瘤细胞和表达 CD3 的 T 细胞,介导 T 细胞对 MUC16 阳性肿瘤细胞的特异性杀伤,促进免疫细胞因子的分泌,改变肿瘤微环境向有利于肿瘤免疫的方向转化,从而起到抗肿瘤作用。
LBL-033 在双抗结构设计,靶向 MUC16 的结合表位以及靶向CD3 的亲和力等多个方面做了大量的优化,以期达到安全性和有效性的平衡。LBL-033 在临床前的体内外药效研究中表现出较强的抗肿瘤作用,在食蟹猴中进行的非临床安全性评价耐受性良好,药代动力学特性与单抗类似。药学研究表明,LBL-033 生产工艺稳定、质量可控、制剂稳定,可以为临床研究提供质量可控的产品。
3、石药集团
:TNFR2 抗体
NBL-020
获批临床
2 月 16 日,石药集团宣布,集团在美国的附属公司 NovaRock Biotherapeutics Limited 自主研发的全人源抗体药物 NBL-020 已获临床默示许可,可在中国开展用于治疗晚期实体瘤的临床试验。
NBL-020 是一种抗肿瘤坏死因子 2 型受体(TNFR2)的全人源单克隆抗体。TNFR2 属于肿瘤坏死因子受体(TNFR)超家族,通过多种信号通路维持肿瘤细胞免疫抑制的微环境,直接或间接促进肿瘤进展。其刺激多种免疫抑制细胞类型,包括调节性 T 细胞(Tregs)及骨髓衍生抑制细胞(MDSCs),并可作为一种癌基因。在肿瘤微环境中使用 TNFR2 抗体抑制高度抑制性的 Tregs 及 MDSCs 有望成为治疗晚期实体瘤的一种新策略。
NBL-020 是由 NovaRock 专有的 AFIS 技术平台发现及开发。临床前研究显示,NBL-020 具有良好的安全性、对靶细胞的亲和力较高及强效的抗肿瘤活性。在 PD-1 敏感及 PD-1 耐药的同基因动物模型中,其作为单一药物或与抗 PD1 抗体联合使用均能抑制肿瘤生长并延长生存期。
虽然 PD-1/PD-L1 抑制剂在实体瘤治疗方面取得显著的突破,但对于 PD-1/PD-L1 耐药/难治性肿瘤仍有大量未满足医疗需求。NBL-020 用于治疗对抗 PD-1/PD-L1 有耐药性及难治性的患者呈现潜在优势。
NBL-020 亦已于 2022 年 12 月获得美国食品药品监督管理局的试验性新药(IND)批准。
4、
中生尚健:CD47/CLDN18.2 双抗 SG1906 获批临床
2 月 17 日,中生尚健生物医药(杭州)有限公司宣布,公司自主研发的靶向 CLDN18.2/CD47 创新双抗项目 SG1906 注射液获得国家药品监督管理局(NMPA)批准开展临床试验,适应症为 CLDN18.2 阳性晚期恶性实体肿瘤。
SG1906 是基于尚健生物 BIMA 双抗平台研发的抗 CLDN18.2/CD47 创新双抗。SG1906 能同时特异性结合CLDN18.2/CD47 分子,介导抗体依赖性细胞介导的细胞毒性(ADCC)、抗体依赖性细胞吞噬作用(ADCP)以及通过阻断 CD47 和 SIRPα 相互作用,解除对巨噬细胞的免疫抑制,增强抗体依赖性细胞介导的吞噬作用,提升巨噬细胞对肿瘤细胞的吞噬作用,发挥协同抗肿瘤效应。
CLDN18.2(Claudin18.2)是一种紧密连接蛋白,广泛表达于上皮和内皮细胞,维持细胞极性和屏障功能以及选择通透功能。
正常情况下 Claudin18.2 仅在胃上皮细胞中表达,具有高度的组织特异性;发生癌变时,Claudin18.2 在多种肿瘤组织中高度表达。除与胃恶性肿瘤密切相关外,在胰腺、食管、肺部等多种肿瘤中均被证实存在异常表达。
正常情况下,Claudin18.2 蛋白仅在埋藏在胃黏膜上已分化的上皮细胞中表达,
而恶性肿瘤的发生会破坏紧密连接,使肿瘤细胞表面的Claudin18.2 分子暴露出来,成为特定靶点。
因而Claudin18.2 被看作具有巨大潜力的抗肿瘤靶点,目前靶向Claudin18.2 的在研药物涵盖了抗体、CAR-T 和ADC 等多种类型。
CD47/SIRPα 是后 PD-1/PD-L1 时代肿瘤免疫领域中最重要的靶点之一。特异性抗体等药物阻断 CD47/SIRPα 信号通路,可解除免疫抑制,恢复巨噬细胞对肿瘤细胞的吞噬活性,解除「别吃我」信号,发挥强大的肿瘤免疫治疗效应。全球针对CD47-SIRPα 通路开发处于临床阶段的药物已超过 30 个,与多种肿瘤治疗策略联合用药呈现积极进展。
SG1906 采用 CLDN18.2 端高亲和力和弱化 CD47 端亲和力的差异化分子设计,以重定位 SG1906 在患者体内的靶向分布,从而在发挥联合抗肿瘤药效的同时降低 CD47 靶点的血液系统安全性风险。
非临床研究显示,SG1906 抗肿瘤作用明确,可发挥「1+1>2」的协同效应,在 CLDN18.2 中低表达的 PDX 肿瘤模型中显示出积极的抑瘤效果;SG1906 安全性良好,未见明显的靶点相关不良反应。SG1906 拟用于治疗 CLDN18.2 阳性晚期恶性实体肿瘤。
SG1906 此前已于 2022 年 10 月获得美国 FDA 批准临床试验。
境外部分,本周共有 7 款创新药(含改良新)研发进度推进到了新阶段,其中 1 款获批上市,1 款申报上市,1 款获批临床,1 款申报临床。
复宏汉霖「曲妥珠单抗」生物类似药上市申请获 FDA 受理
2 月 14 日,复宏汉霖宣布,公司联合其商务合作伙伴 Accord BioPharma Inc.(Accord US)共同推动递交汉曲优®(注射用曲妥珠单抗)在美国的上市许可申请(BLA),并于近日正式获得美国食品药品监督管理局(FDA)受理,拟用于辅助治疗 HER2 过表达的早期乳腺癌、HER2 过表达的转移性乳腺癌,以及 HER2 过表达的转移性胃腺癌或胃/食管交界处腺癌。
2021 年,复宏汉霖与 Accord US 签署授权许可协议,授予其在美国及加拿大地区对汉曲优®进行独家开发和商业化的权利。
汉曲优®是复宏汉霖严格按照中国、欧盟和美国等生物类似药法规自主研发的曲妥珠单抗,目前已在全球 30 多个国家获批上市,累计惠及超过 100000 位中国患者。此次汉曲优®上市许可申请获美国 FDA 受理,有望进一步深化公司国际化布局。乳腺癌目前已成为全球发病率最高的肿瘤,曲妥珠单抗是 HER2 阳性乳腺癌治疗的基石药物。我们期待通过与 Accord 的合作,让汉曲优®惠及全球更多患者。
汉曲优®为首个中国自主研发的中欧双批单抗药物,于 2020 年 7 月及 8 月先后获得欧盟委员会与中国国家药监局(NMPA)批准上市,用于 HER2 阳性早期乳腺癌、转移性乳腺癌和转移性胃癌,即涵盖原研已获批准的所有适应症。
汉曲优全球项目开发概览
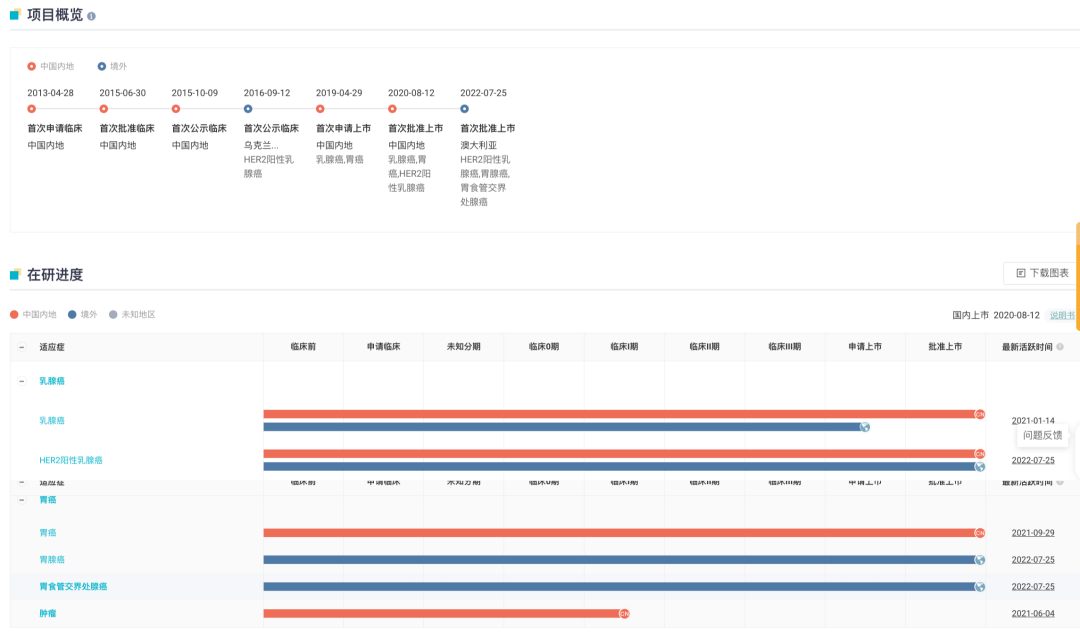
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
复宏汉霖针对汉曲优®开展了一系列的头对头比对研究,包括质量对比研究、临床前研究及临床 I 期和国际多中心临床 III 期研究等。这些数据充分证明了汉曲优®与原研曲妥珠单抗在质量、安全性和有效性方面高度相似。
围绕汉曲优®,复宏汉霖前瞻性地开展了国际商业化布局,积极开拓海外市场,携手全球商业合作伙伴 Accord Healthcare、Abbott、Cipla、Eurofarma、Mabxience 和雅各臣药业等国际一流的生物制药企业,全面布局美国、加拿大、欧洲以及众多新兴国家市场,覆盖全球约 100 个国家和地区。
作为国产生物药「出海」代表,汉曲优®(欧洲商品名:Zercepac®,澳大利亚商品名:Tuzucip® 和 Trastucip®)已于英国、法国、德国、瑞士、澳大利亚、芬兰、西班牙、阿根廷、沙特阿拉伯等超过 30 个国家和地区成功获批上市。
1、智康弘义:靶向 CDH3 ADC 在美国获批临床
2 月 13 日,智康弘义宣布,全球首创新一代靶向CDH3 的 ADC 药物 BC3195 获得美国 FDA 临床研究许可,该公司已同步向国家药品监督管理局(NMPA)递交了 BC3195 的 IND 申请并于 1 月 17 日获受理。智康弘义计划近期在中美同步开展 BC3195 拟用于治疗晚期实体瘤的 Ⅰ 期临床研究。
BC3195 全新靶向的 CDH3 蛋白属于细胞黏附分子家族,是一种钙依赖型的介导细胞-细胞粘附的糖蛋白,在多种恶性实体肿瘤(如肺癌和乳腺癌等)中高表达,而在正常组织中表达较少,是理想的、具有高度潜力的可针对多种恶性实体肿瘤的 ADC 靶点。
BC3195 在临床前研究中表现出非常出色的抗体内吞活性和安全性,具有优异的肿瘤抑制活性,在多个肿瘤模型中的 TGI(Tumor Growth Inhibition Value,肿瘤生长抑制率)大于 100%。
2、同源康医药:CDK7 抑制剂 TY-2699a 获 FDA 临床批准
2 月 17 日,同源康医药宣布,其自主研发的新一代口服、高效、高选择性的小分子 CDK7 抑制剂 TY-2699a 获得美国食品药品监督管理局(FDA)同意开展临床试验的正式函件。这是同源康医药第三个获得 FDA 批准临床试验的创新药。
TY-2699a 是同源康医药自主研发的一款口服的高效、高选择性的小分子 CDK7 抑制剂,拟用于治疗多种晚期肿瘤,如乳腺癌、卵巢癌、前列腺癌、胰腺癌、小细胞癌及血液瘤等。
TY-2699a 在临床前体外及体内药效试验中对多个瘤种展现了良好的抑制作用,同时具有良好的耐受性和安全性,为后期临床研究的探索提供了有力的依据。此外,在 CDK4/6 抑制剂获得性耐药的乳腺癌模型中也表现出良好活性,提示 TY-2699a 是潜在应对 CDK4/6 靶向治疗后耐药的选择。
TY-2699a 是国内首款获得美国 FDA 批准临床试验的CDK7 抑制剂。目前全球没有获批上市的 CDK7 抑制剂,仅有 4 款药物处于早期临床试验阶段(均为 I/II 期),国内尚无进入临床开发阶段的研究药物,庞大的临床需求仍未得到满足。
同时,同源康医药已与国家食品药品监督管理局(NMPA)药品审评中心(CDE)进行了 TY-2699a 的 Pre-IND 沟通交流,将于近期正式提交 IND,有望于 2023 年 5 月获得 NMPA 批准的临床试验通知书。
CDK7 是细胞周期依赖性激酶 (cyclin-dependent kinases,CDK) 家族的成员之一,同时也是多蛋白基础转录因子 TFIIH 的一个亚基,是细胞周期进程和基因转录的主要调节因子,现已经成为癌症潜在的热门靶点。
在细胞周期过程中,CDK7 与细胞周期蛋白 H(cyclin H)、激活亚基 MAT1 结合后形成细胞周期激酶(CAK),并通过激活家族其他激酶(如CDK1/2/4/6)来控制细胞,尤其癌细胞的细胞周期。
CDK7 还参与组成多蛋白基础转录因子 TFIIH,在细胞周期的转录和调节发挥关键作用,并与由异常转录控制(例如 MYC-、ESR1- 激活)的基因和/或异常细胞周期控制(例如 RB1、CCNE1、CDKN2A 改变)的基因驱动的多种肿瘤类型有关。
研究表明,多种肿瘤细胞的生长增殖对 CDK7 存在高度依赖,包括三阴性乳腺癌(TNBC))、复发或难治性卵巢癌(OC)、胰腺导管腺癌(PDAC)、以及血液肿瘤等。
CDK7 抑制剂有望成为这类肿瘤的潜在治疗方案。
免责声明:本文仅作信息分享,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
投稿:微信 insightxb;邮箱 insight@dxy.cn
Insight 数据库网页版等你体验




















 个人中心
个人中心
 我是园区
我是园区




