NBT | HIV治疗新突破:通过体内B细胞编辑产生治疗性抗体
收藏
关键词:
新突破
资讯来源:BioArt + 订阅账号
发布时间:
2022-07-07

撰文 | 言笑
HIV给人类健康造成了巨大威胁,据统计目前全球有近3800万艾滋病患者。虽然口服抗逆转录病毒药物在控制艾滋病毒水平方面非常有效,但这些药物需要持续服用,并且很多具有较大的副作用,因此,彻底治愈的疗法才是终结HIV的关键。随着研究的深入,越来越多的长效抗病毒药物已被批准,如2021年1月FDA批准的Cabenuva
(卡博特韦/利匹韦林)
,该药仅需一个月注射一次。除了抗病毒药物,广谱中和抗体
(Broadly neutralizing antibodies, bNAbs)
也受到人们的广泛关注。这些抗体靶向HIV表面的膜蛋白ENV,可以有效的阻碍病毒对宿主细胞的感染。但是因为HIV病毒的高变异性,在临床中仅使用一种bNAb可能导致病毒的耐药性,因此目前很多研究者开始研究利用单抗联合或者双特异抗体对HIV进行治疗。
有研究表明,在感染的早期阶段开始接受抗逆转录病毒治疗
(Anti-Retroviral Therapy, ART)
的HIV感染者,在接受两种HIV bNAbs
(3BNC117和10-1074)
后,在没有ART的情况下获得了长时间的HIV抑制
【1】
。这两种bNAbs的平均半衰期分别为16天和23天,病毒会在一定时间内反弹
【2】
。bNAb的持久性可以通过病毒载体转导后肌肉的组成性表达来维持,但可能会由于糖基化不当而产生抗药物抗体
【3-5】
。此外,从肌肉表达的抗体不会经历类转换重组
(class switch recombination, CSR)
或亲和力成熟
(affinity maturation)
。针对这些问题,研究者开发了用于抗体表达的工程B细胞
【6-10】
。将Toll样受体
(Toll-like receptor, TLR)
介导的B细胞离体活化与体内初免-加强
(prime-boost)
免疫结合起来,工程化B细胞允许免疫记忆、CSR、体细胞超突变
(somatic hypermutation, SHM)
和克隆选择。通过工程离体移植以分泌bNAbs的B细胞在疾病模型中显示出疗效。然而,这种方法的临床转化需要专门的医疗中心、技术要求苛刻的方案以及供体细胞和受体的主要组织相容性复合体兼容性,因此,严重阻碍了该方法的扩大和应用。
近日,来自以色列特拉维夫大学的Adi Barzel团队在Nature Biotechnology杂志上在线发表了题为
In vivo engineered B cells secrete high titers of broadly neutralizing anti-HIV antibodies in mice
的文章。研究人员
通过使用两种腺相关病毒载体
(一种编码金黄色葡萄球菌Cas9,另一种编码抗HIV bNAb 3BNC117)
成功地实现了体内B细胞工程。
将载体静脉注射到小鼠体内后,B细胞被成功编辑并导致记忆保留和bNAb分泌,中和滴度高达6.8 µg ml-1。研究人员证实,
用于表达治疗性抗体的体内B细胞工程是一种安全、有效和可扩展的方法,它不仅适用于传染病,还适用于非传染性疾病
(例如癌症和自身免疫性疾病)
的治疗。

为了在体内实现B细胞编辑,作者采用了一对AAV-DJ载体
(图1)
。第一个载体中,金黄色葡萄球菌Cas9
(Staphylococcus aureus Cas9, saCas9)
由CMV启动子表达,sgRNA
(靶向IgH基因座)
由U6启动子表达,二者编码在相同的AAV上;第二个载体编码3BNC117 bNAb cassette,两侧有同源臂,用于整合到IgH基因座J-C内含子的CRISPR Cas9剪切位点。bNAb cassette在增强子依赖性启动子
(enhancer-dependent, ED)
的控制下在整合时表达,其包括完整的轻链和重链的可变区
(VL和VH)
,被编码Furin切割位点和2A肽的序列分隔。可变重链之后是剪接供体序列,以允许与内源性常数外显子在整合、转录和剪接时融合。上游多聚腺苷酸化位点用于终止整合时内源性可变重链的转录。该设计有助于破坏内源性IgH基因座和初始bNAb表达,允许随后在抗原结合上激活工程化 B 细胞,从而导致分化为记忆细胞和浆细胞。
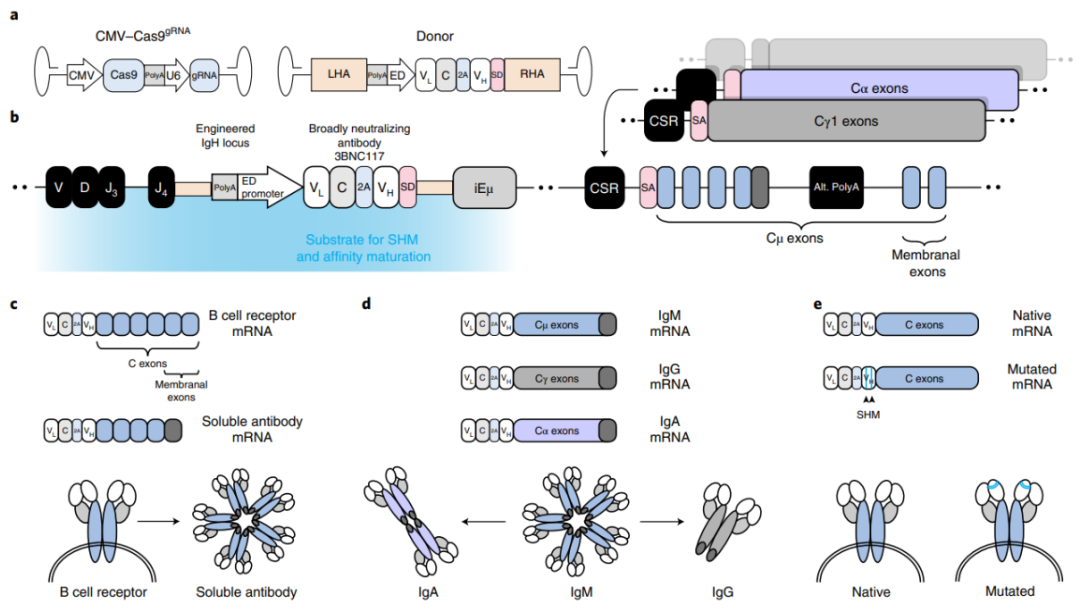
图1. 将抗体靶向B细胞IgH位点,以促进抗原诱导的活化、SHM、CSR和亲和力成熟。
对小鼠注射AAV之前先进行预免疫,模拟预先存在的感染。用gp120 HIV抗原
(3BNC117的靶标)
免疫C57BL/6小鼠。在免疫后第6天,注射bNAb、saCas9载体或两者同时注射。这些小鼠在第8、23、68、98和128天接受额外的免疫接种。在加强方案之后,接受供体载体和saCas9载体的小鼠血液中含有高达5 µg ml-1的3BNC117 bNAb。从治疗小鼠中纯化的IgG可以中和自体YU2.DG和异源tier-2 JRFL HIV假病毒。同时注射bNAb和saCas9载体的小鼠比仅接受bNAb的小鼠具有高得多的3BNC117滴度。进一步,通过在骨髓上使用酶联免疫吸附点
(enzyme-linked immunosorbent spot, ELISPOT)
,证实了3BNC117分泌细胞的存在。这些数据表明,体内B细胞工程可实现抗HIV bNAb的高滴度。
在注射了bNAb和saCas9载体的所有小鼠中,表达3BNC117的细胞达到了总血B细胞的0.5%,在对照小鼠中则没有。第136天对小鼠实施安乐死,脾脏中表达3BNC117的浆母细胞占23%、生发中心淋巴细胞占5%。作者在第136天接受治疗的小鼠的肝脏和脾脏中提取了DNA,并对扩增的3BNC117 VH片段进行了Illumina测序。大部分突变库在肝脏和脾脏之间共享,反映了AAV产生的异质性。作者发现,体内编辑和免疫计划导致了变异的克隆扩展,这些变异源于AAV生产的异质性或体内SHM的异质性。克隆扩展的跨度有限,但幅度显著。这些数据表明,体内工程化B细胞在生发中心经历克隆扩张。
接下来,作者评估了体内工程方法的脱靶效应。对各组织中bNAb cassette的拷贝数进行量化,第37天的肝脏中的拷贝数最高,并在第136天仅降低了十倍,反映了肝脏中AAV episomes的高保留率。在第37天的血液中也发现了高拷贝数,但到第136天,水平急剧下降。从第37天到第136天,骨髓和淋巴结中的AAV拷贝数逐渐增加,表明这些组织中可能积累了表达3BNC117的细胞。作者还评估saCas9的全基因组脱靶活性。对小鼠基因组DNA进行CHANGE-seq,95%对应于on-target site。然后,对四个潜在的off-target位点以及on-target位点进行靶向测序。结果表明CRISPR-Cas9诱导的双链DNA断裂的易出错修复在肝脏中更明显,并且仅在IgH on-target位点。进一步,作者证实在CRISPR-Cas9介导的靶向整合之前,B细胞和非B细胞都可以在膜上表达抗体,但只有B细胞在抗原参与后增殖。
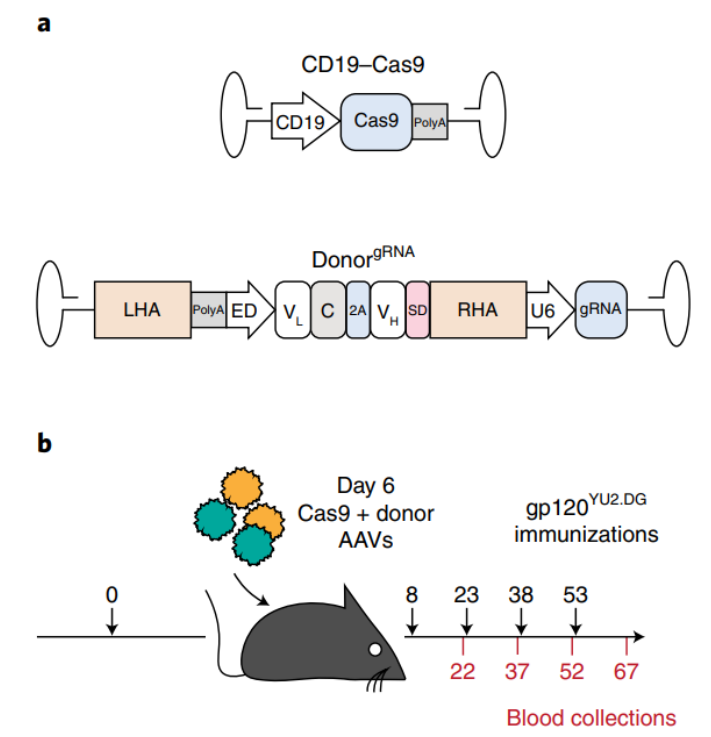
上述结果表明,CRISPR-Cas9切割具有高度的序列特异性,但也发生在不需要的组织中。为了进一步提高该方法的安全性,作者在CD19
(B细胞特异性启动子)
的控制下对saCas9进行了编码。C57BL6小鼠免疫20 ug HIV gp120,6天后,每只小鼠共注射一个由CD19启动子调控的saCas9载体,以及一个同时编码bNAb和sgRNA的载体
(图2)
。然后小鼠接受了六次额外免疫接种。在四次免疫接种后,接受治疗的小鼠血液中已经含有高达 2 μg ml-1 的3BNC117 bNAb。无论是否进行了额外免疫接种,3BNC117 血液滴度在 30 天后保持不变。不管免疫方案如何,使用混杂或 B 细胞特异性调节saCas9表达获得了相似的滴度。因此,通过B细胞特异性启动子驱动 Cas9 表达可防止在不需要的组织中进行切割。
总的来说,该研究证明了B细胞可以在体内安全可靠地进行工程设计。单次全身剂量的双AAV-DJ编码小鼠CRISPR-Cas9和供体cassette允许位点特异性整合。在免疫接种时,工程化B细胞经历了抗原诱导的激活,导致记忆保留、克隆选择和分化为分泌bNAb 的浆细胞。与体外工程相比,体内B细胞工程简单、快速且具有成本效益。它可以在护理点提供,不需要专门的设施。但该方法目前也没有十分完善,作者认为可以从以下几方面进行优化:(1)将bNAb编码为单链以减少bNAb 重链与内源性轻链的错配,从而提高安全性和有效性;(2)使用更特异性的核酸酶和使bNAb基因之前有剪接受体而不是启动子,可以进一步提高安全性,以减少脱靶整合的表达;(3)在感染HIV样感染的非人类灵长类动物中对该方法进行评估;(4)将该方法应用在其他持续性感染以及自身免疫性疾病、遗传性疾病和癌症中。
https://doi.org/10.1038/s41587-022-01328-9
制版人:十一
1. Mendoza, P. et al. Combination therapy with anti-HIV-1 antibodies maintains viral suppression. Nature 561, 479-484 (2018).
2. Cohen, Y. Z. et al. Safety, pharmacokinetics, and immunogenicity of the combination of the broadly neutralizing anti-HIV-1 antibodies 3BNC117 and 10-1074 in healthy adults: a randomized, phase 1 study. PLoS ONE 14, e0219142 (2019).
3. Johnson, P. R. et al. Vector-mediated gene transfer engenders long-lived neutralizing activity and protection against SIV infection in monkeys. Nat. Med. 15, 901-906 (2009).
4. Balazs, A. B. et al. Vectored immunoprophylaxis protects humanized mice from mucosal HIV transmission. Nat. Med. 20, 296-300 (2014).
5. Priddy, F. H. et al. Adeno-associated virus vectored immunoprophylaxis to prevent HIV in healthy adults: a phase 1 randomised controlled trial. Lancet HIV 6, e230-e239 (2019).
6. Huang, D. et al. Vaccine elicitation of HIV broadly neutralizing antibodies from engineered B cells. Nat. Commun. 11, 5850 (2020).
7. Fusil, F. et al. A lentiviral vector allowing physiologically regulated membrane-anchored and secreted antibody expression depending on B-cell maturation status. Mol. Ter. 23, 1734-1747 (2015).
8. Greiner, V. et al. CRISPR-mediated editing of the B cell receptor in primary human B cells. Science 12, 369-378 (2019).
9. Hartweger, H. et al. HIV-specifc humoral immune responses by CRISPR/ Cas9-edited B cells. J. Exp. Med. 216, 1301-1310 (2019).
10. Mofett, H. F. et al. B cells engineered to express pathogen-specifc antibodies protect against infection. Sci. Immunol. 4, eaax0644 (2019).
【原创文章】BioArt原创文章,欢迎个人转发分享,未经允许禁止转载,所刊登的所有作品的著作权均为BioArt所拥有。BioArt保留所有法定权利,违者必究。






 药选址
药选址




