 CDE官网最新公示,诺华(Novartis)公司申报的QGE031注射液已获得临床试验默示许可,针对适应症为慢性诱导性荨麻疹。QGE031注射液(也称作 ligelizumab)是新一代人源抗IgE单克隆抗体,曾被美国FDA授予突破性药物资格,用于治疗对H1抗组胺治疗应答不足的慢性自发性荨麻疹(CSU)患者。公开资料显示,ligelizumab(QGE031)为一款新一代IgE抗体疗法,目前在全球范围内处于3期临床试验阶段。此前,该药曾被美国FDA授予突破性疗法认定,用于治疗抗组胺疗法应答不足的慢性自发性荨麻疹。
CDE官网最新公示,诺华(Novartis)公司申报的QGE031注射液已获得临床试验默示许可,针对适应症为慢性诱导性荨麻疹。QGE031注射液(也称作 ligelizumab)是新一代人源抗IgE单克隆抗体,曾被美国FDA授予突破性药物资格,用于治疗对H1抗组胺治疗应答不足的慢性自发性荨麻疹(CSU)患者。公开资料显示,ligelizumab(QGE031)为一款新一代IgE抗体疗法,目前在全球范围内处于3期临床试验阶段。此前,该药曾被美国FDA授予突破性疗法认定,用于治疗抗组胺疗法应答不足的慢性自发性荨麻疹。

截图来源:CDE官网
慢性自发性荨麻疹(CSU)的典型表现为在无特定外部刺激的情况下出现风团、血管性水肿的荨麻疹表征,且症状往往严重和不可预测,会对患者生活产生长期负面影响。CSU的发病机制尚不完全清楚,但目前已知的发病原因与自身免疫机制息息相关。

根据ClinicalTrials.gov网站信息,目前ligelizumab针对抗组胺药控制不佳的青少年、成人慢性诱导性荨麻疹(CINDU)患者正在展开3期临床研究(PEARL-PROVOKE研究)。
Ligelizumab(QGE031)是新一代单克隆抗免疫球蛋白E(IgE)抗体。Ligelizumab被认为通过阻断IgE/FcεRI通路起作用,该通路是CSU中炎症过程的关键驱动因子。
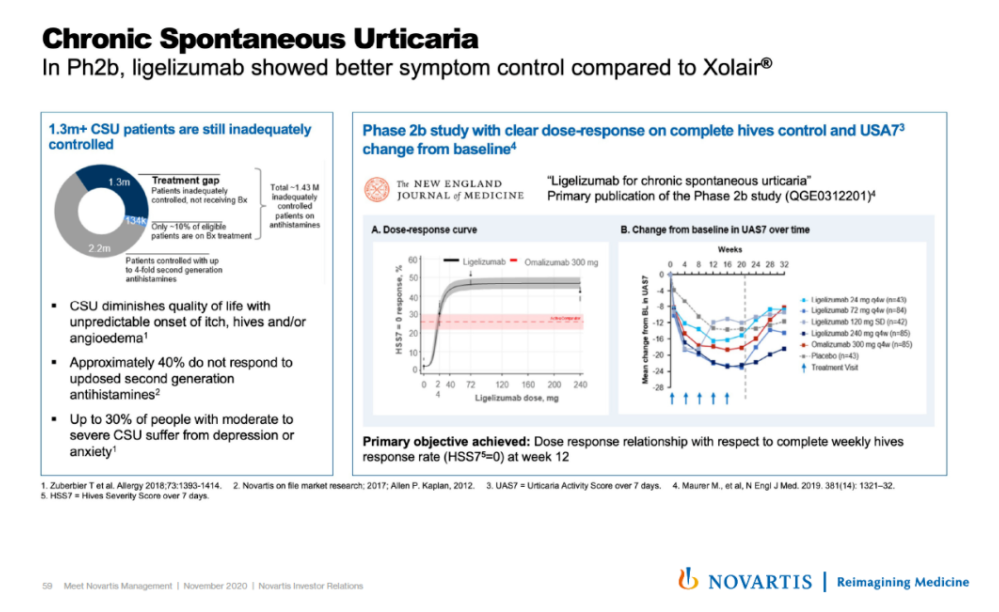
▲Ligelizumab的一项2b期临床试验结果(图片来源:诺华官网)
在一项2b期剂量探索试验中,与上一代IgE抗体omalizumab相比,更多的患者使用ligelizumab后症状完全消退。在一项针对抗组胺药控制不佳的CSU患者的2b期剂量探索试验中,与omalizumab或安慰剂相比,未发现ligelizumab的安全性问题。目前正在进行的3期临床试验项目已在全球48个国家招募了超过2000例患者,预期在2021年下半年获得结果。
除了ligelizumab以外,诺华还在2期临床试验中检验布鲁顿氏酪氨酸激酶(BTK)抑制剂remibrutinib(LOU064)治疗慢性自发性荨麻疹的效果。
“慢性自发性荨麻疹可能显著影响患者的生活。由于可用的治疗选择非常少,患者正在寻找更多更好的疗法来控制他们的病情。”诺华肝脏、皮肤病、和免疫学部全球开发负责人Angelika Jahreis博士说,“FDA的突破性疗法认定显示了解决这些患者未满足医疗需求的急迫性。”

识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!
请注明:姓名+研究方向!


本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。




 个人中心
个人中心
 我是园区
我是园区




