
众所周知,侵袭性三阴性乳腺癌(TNBC)缺乏常规药物靶点表达,早期和晚期疾病的总生存率很差。Roche/BioNTech发起的“TNBC-MERIT”是一项I期试验(NCT02316457),用于评估手术和(新)辅助化疗后TNBC患者静脉注射编码不同肿瘤抗原类别的脂质体RNA疫苗的可行性,安全性和免疫原性。最新进展显示,该研究已经完成39名患者招募,将于2020年11月1日完成试验。(MERIT:The Mutanome Engineered RNA Immuno-Therapy)
TNBC-MERIT试验使用两种互补策略,即IVAC®WAREHOUSE(又名BNT114)和IVAC®MUTANOME(又名BNT121)概念,从而为每位患者提供了两种定制的IVAC® investigational medicinal products (IMPs)。
试验设计方案为:前两组患者接受了提前定制好的非突变共有肿瘤相关抗原,即IVAC®WAREHOUSE,分别带有或不带有通用的辅助性T细胞表位。例如第一组患者接受四种RNA的治疗,其中包括从BNT114选出的2至3个变异RNA(通过RT-PCR分析,以及预先确定的cut-off值筛选出3种RNA)加p53 RNA。在第三组中,为患者接种了BNT121疫苗,也就是IVAC®MUTANOME,这是一种个体化新生抗原特异性免疫疗法(iNeST),编码衍生自NGS确定的多达20种癌症突变表位。在本次ESMO报告中BioNTech 以poster的形式发布了BNT121疫苗接种患者的免疫应答(通过IFNγ-ELISpot,多聚体染色)的初步数据分析结果。
结果显示,14位接受BNT121治疗的患者中均产生免疫原性数据。诱导大量针对单个新表位的T细胞反应,反应强度很高(高达外周血CD8+T细胞的10.3%),其中一位患者10种新生抗原的CD4 +和CD8+T细胞出现应答。此外,完成疫苗接种后,T细胞可以维持至少6个月的高水平反应。
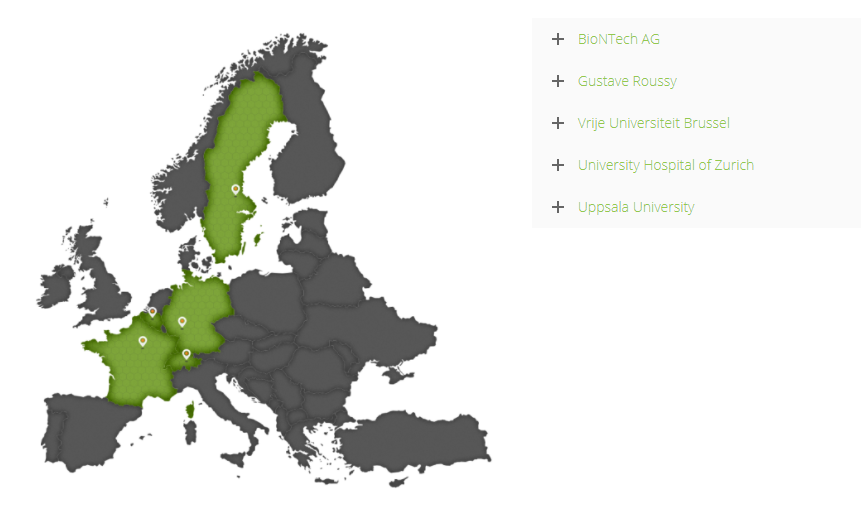
另外,因为MERIT项目(The Mutanome Engineered RNA Immuno-Therapy (MERIT) project)得到了《欧盟研究、技术开发及示范活动第七框架计划》约780万欧元的支持,BioNtech将带领其他4家成员(如上图)完成GMP级别RNA疫苗生产、共有新生抗原筛选、监测临床试验中疗效相关的Biomarker等7项指标,建立肿瘤共有抗原的RNA疫苗仓库,以解决超过95%的TNBC患者的需要,并建立及时按需生产针对多种肿瘤特异性突变的个性化RNA疫苗的生产工艺。

结果显示,在18位泛癌种的患者中鉴定出4~99种新生抗原。迄今为止,已有8例患者接受了GEN-009疫苗接种:6例与SOC PD-1 CPI联合接种,在疫苗接种之前出现进展的2例患者接受了挽救方案,总计共注射24剂疫苗。与GEN-009相关的AE包括4位患者的1级注射部位反应,无DLT。
有趣的是,通过监测发现,经过ATLAS™筛选得出的刺激性和抑制性多肽在PD-1治疗期间发生了“反转式”的变化,出现更多的刺激性靶点和更少的抑制性靶点,这无疑显示了CPI联合个体化疫苗的强强作用机制。

LN-145是一种离体扩增的自体肿瘤浸润淋巴细胞(TIL)产品,此前NCI的临床研究中证明TIL对晚期宫颈癌患者有效,具有44%的ORR和85%的DCR。NCT03108495旨在采用非清髓性淋巴结清扫准备方案后,评估输注LN-145继之以IL-2的过继细胞疗法用于治疗复发,转移或持续性宫颈癌的患者。本次ESMO会议上,Iovance发布了LN-145 clonal TIL的组成,clonal TIL的体内机制与临床反应,患者接受TIL治疗的持续性以及HPV反应性之间的关系。
研究方案设计:对来自27位患者的LN-145 TIL产品进行CDR3 RNA-seq检测并建立一个repertoire,然后在每个患者的输注前和输注后通过PBMC进行监测。使用已知的统计方法来确定克隆多样性,样品之间的重叠以及与临床反应和HPV反应性的相关性(通过与载有多肽的自体APC共同培养进行评估)。
结果显示,特异性的clonal TIL和相应的多样性指数分别平均为25,222 [3,829-87,751]和7.83 [4.7-11.4],并沿着前后曲线分布,其中10个最丰富的clonal TIL占总 repertoire 约42%,在27例患者中,有3例检测到少于1%的克隆。Clonal TIL在所有输注后的时间点都持续存在。D42共有2043个克隆,分别代表LN-145和PBMC的11%和20%,以及total TIL(66%)和total D42(57%)组成的很大一部分。此外,多达47%的TIL产品对HPV没有响应。
总而言之,LN-145是一种高度多克隆且个体化的产品,具有体内持久性。每种TIL产品的特异性以及对HPV非反应性TIL的反应观察都突出了鉴定单个TCR作为活性的共同介质的挑战,同时也证明可以使用LN-145和个体化新生抗原来治疗实体瘤。




 个人中心
个人中心
 我是园区
我是园区




