mRNA作为生物中心法则的一个中间角色,一直备受关注。2010年前后,LNP递送技术的突破,促进了mRNA的大发展,使其成为当下最具代表性的新技术之一。
mRNA的应用场景非常宽广,除了目前我们了解到的肿瘤疫苗、传染病疫苗
(尤其是新冠)
之外,mRNA未来的应用场景会逐渐向其他领域扩展,比如蛋白替代。因此,这里面也充满了不少机会。

恺佧生物成立于2018年3月,目前有近200名员工,80%从事生产研发。
在平台建设上,我们开发了独有的创新型功能重组蛋白和抗体研发生产SAMS™平台,以及分子克隆、细胞培养、蛋白纯化和质控平台、酶促反应分析平台、细胞功能评价平台,MES生产管理体系。
目前,我们已建有GMP车间、实验室和办公面积近5000平方米,一流的分析仪器和生产设备配置,以及即将投产的上万平方米上海临港二期GMP车间,使得我们具备过亿元订单年交付能力。截至目前服务超过250家生物医药和诊断客户,参与2000多个目录蛋白产品。
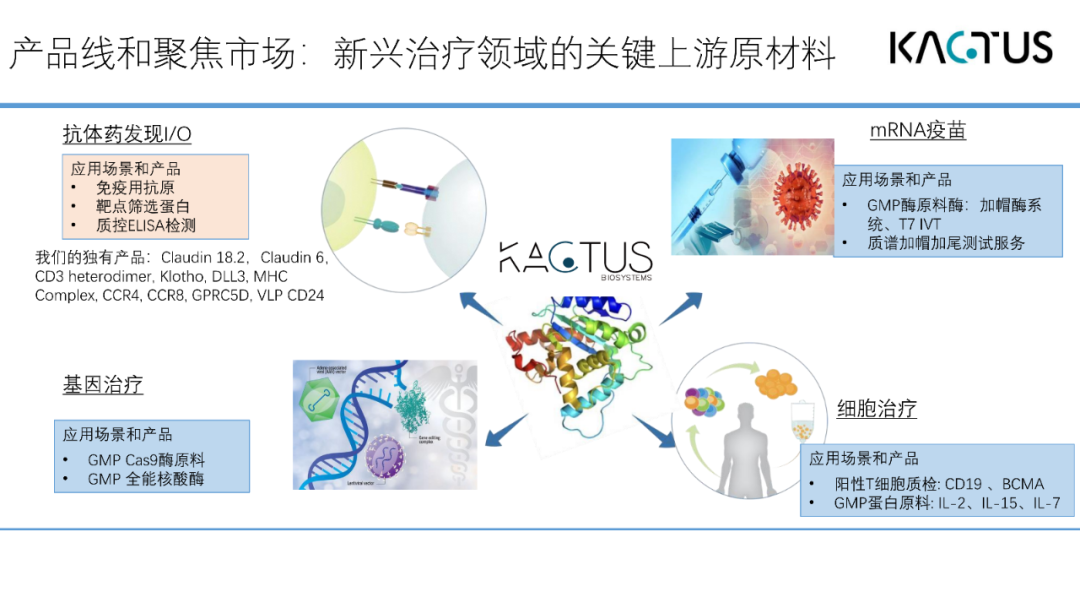
我们主要聚焦新兴治疗领域的关键上游原材料,除了mRNA疫苗。还包括抗体药发现I/O、基因治疗、细胞治疗等。
mRNA合成过程中使用的酶关键指标的质控,对下游企业的生产工艺稳定性至关重要。随着整个产业链的逐渐发展和成熟,未来对酶的要求也会逐渐提高。除了符合CGT领域原料酶的GMP申报要求,恺佧所有酶都经过高精确活性定量放行,比如特别引进了LC-MS系统对加帽酶和2'-O-甲基转移酶进行测活放行。
从早期质粒的信息化,到mRNA的合成、加帽、加尾,整个过程需要一系列的酶。我们可以提供不同的选择方案。
首先一个产品是BsaI。这个酶在科研领域里有非常多的应用,应用时间也很长,但BsaI添加了BSA作为保护剂和稀释剂,在工业领域可能出现问题。因为BSA一般来自动物,即使采用重组的BSA,还是容易带来蛋白残留控制的压力。考虑到这两个痛点,我们直接通过优化配方摆脱BSA。
为了印证方法的可靠性,我们进行反复的冻融实验。我们将带BSA和不带BSA的酶进行对比,在37℃的环境下,30分钟的反应没有任何区别,持续到16小时继续观察无星活情况。可以看到,加不加BSA的效果是一样的。
我们还做了一个37℃的加速实验,也分别在30分钟和16小时的质粒酶切反应时间进行对比,考察其活力和星活情况。在前4天的37℃加速实验,活力基本上没有影响。第5天时稍微会有一点影响,但在实际的使用场景里基本不会发生,因为我们不太会把酶暴露在37℃环境下长达5天。

其次是噬菌体T7,这可能是我们整个mRNA生产过程中最核心的一个酶,是非常高效的单结构蛋白。T7和细菌、真核生物对比,后二者分别有5个亚基、12个亚基。如果是这样的生产工具,单单生产和表达,难度、成本都会非常大。因此,T7是最理想的一个生产工具。
T7在科研领域也得到很长时间的应用,而工业领域对产量要求比较高,涉及疫苗生产成本。到达终端,则影响患者的可及性。
T7有多种影响因素,包括酶、模板、镁离子、NTP的核心四要素,以及一些辅助因素,像表面活性剂焦磷酸酶DTT,还有亚氰胺、阴阳离子,都可以通过调整配方,实现高产率的开发。
但具体操作时,还是存在一定难度。每一个因素都有一个最适浓度,不同因素的最适浓度不是简单的叠加,比如镁离子和NTP,如果镁离子浓度比较低,很有可能会被NTP耦合,造成T7能有效利用的镁离子减少,最终导致低产率。
我们可以通过DOE的方法开发配方。通过从多因素的高低浓度,到关键因素的中高低浓度,再到一些精细的筛选,我们实现了结合数学模型的DOE方案进行开发。

双链RNA的形成机制有两条。第一条是形成机制,也就是在特定的情况下,T7可能不会依赖于T7启动制,形成一个错误的转录。但模板如果带有polya结构,则可以非常高效地进行抑制该机制。
第二条是转录完成之后没有及时解离,继续利用mRNA本身作为模板,反向合成互补链,称为3’端延伸。根据专利文献,在50℃高温条件下,T7酶和RNA结合的力度会受到影响,在末端及时解离,从而降低双链RNA的产生几率。而50℃高温对一次性反应设备不太友好,无法用于工业规模的生产。但我们找到了其它的解决策略,通过对T7酶和buffer的优化来最大限度的减少双链RNA的3’端延伸。
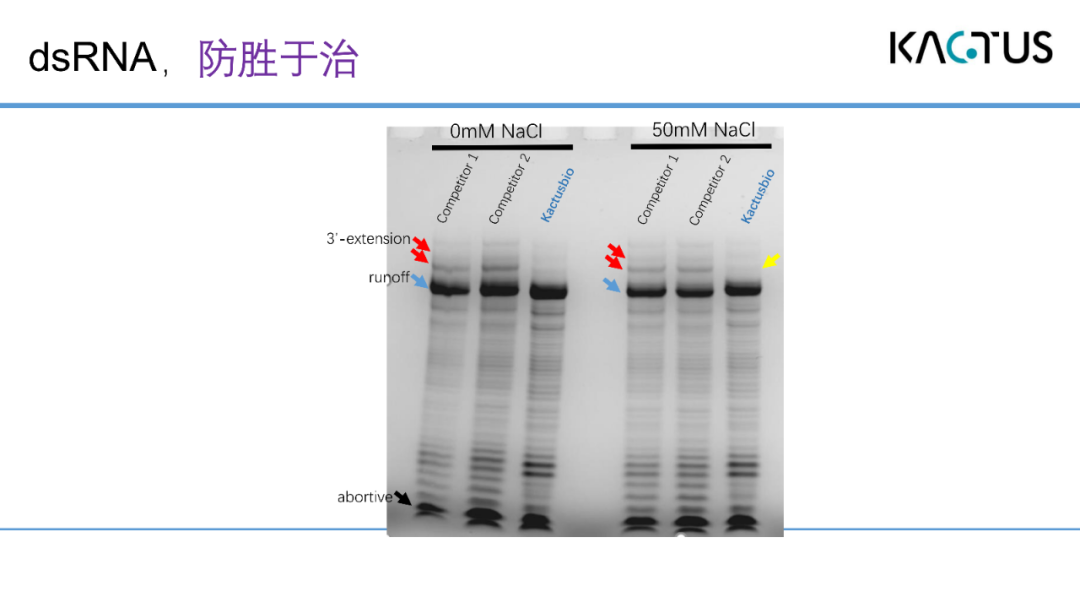
我们做了一个验证实验,采用了一个短模板进行转录,再进行尿素电泳,可以看到对比两家国外竞品恺佧的酶在不同盐离子浓度强下产生的3’端延伸非常少。换言之,要解决双链RNA的问题,最好的办法是防胜于治,我们的T7系统可以很好的解决这方面的痛点。
在T7酶活精确定量方面,早期方法的稳定性差异很大。例如转录产量法,正负30%都很正常。因此,我们后来开发了独创性的探针法,将探针的结合位点放在2000nt的模板尾端,只有合成完整的RNA,信号才会被捕捉到。在我们的分析里,分别投入50U、40U和30U,观察反应速率和差异,对酶活进行精确定量。
基于这样的方法,我们对T7酶在37℃加速实验和反复冻融的稳定性研究,可以看到它的一个活性基本上能维持在90%以上。

此外,我们还对无焦磷酸酶、DNase I进行了研究。无焦磷酸酶对产率的影响非常明显,大概有30%~40%以上的提高;而高活性DNase I可以高效去除转录模板。
加帽方法目前是分为两种,一种是共转录加帽,目前处在第三代,也就是以Cleancap为代表的共转录方式;另外一种是牛痘加帽酶法加帽,它可以实现非常高的加帽率,接近100%,这也是我们推荐的方法。
为什么需要这么高的加帽率?大量的研究已经证明,从Cap1、Cap0,再到不加帽,免疫原性是逐渐提高的。为了降低疫苗的免疫原性,我们需要实现尽可能高的Cap1加帽率。

Cap1其实是在两个酶的共同作用下实现的,一个是加帽酶,另一个是甲氧基转移酶。那么,共转录加帽法和酶法加帽哪个更好?
我们可以从两个维度进行分析。第一个是加帽率,像Cleancap这种方式的加帽率,一般在90%~95%左右;而酶法加帽的加帽率,可以接近100%。技术上来说,后者更有优势。
第二个维度是成本,酶法加帽在IVT之后,需要多一套纯化工艺再进行加帽,再加上设备成本,都会导致整体成本的增加。但同时需要注意,Cleancap结构拥有专利,后期会有license-fee的问题。
就总体考虑,行业详细估算过,目前这两个成本非常接近,如果考虑license-fee,可能酶法加帽更有优势。尤其是随着未来产业的逐渐成熟,以及酶法加帽生产规模不断扩大,成本分摊会更低,能够帮助疫苗企业实现成本降低。恺佧的加帽酶经过改造,产率相比野生型有了很多倍的提高,希望能够为业界赋能。

















 个人中心
个人中心
 我是园区
我是园区




