根据医药云端工作室统计,2020年10月18日-2020年10月25日,新增27个品种(视同)通过一致性评价,具体如下:
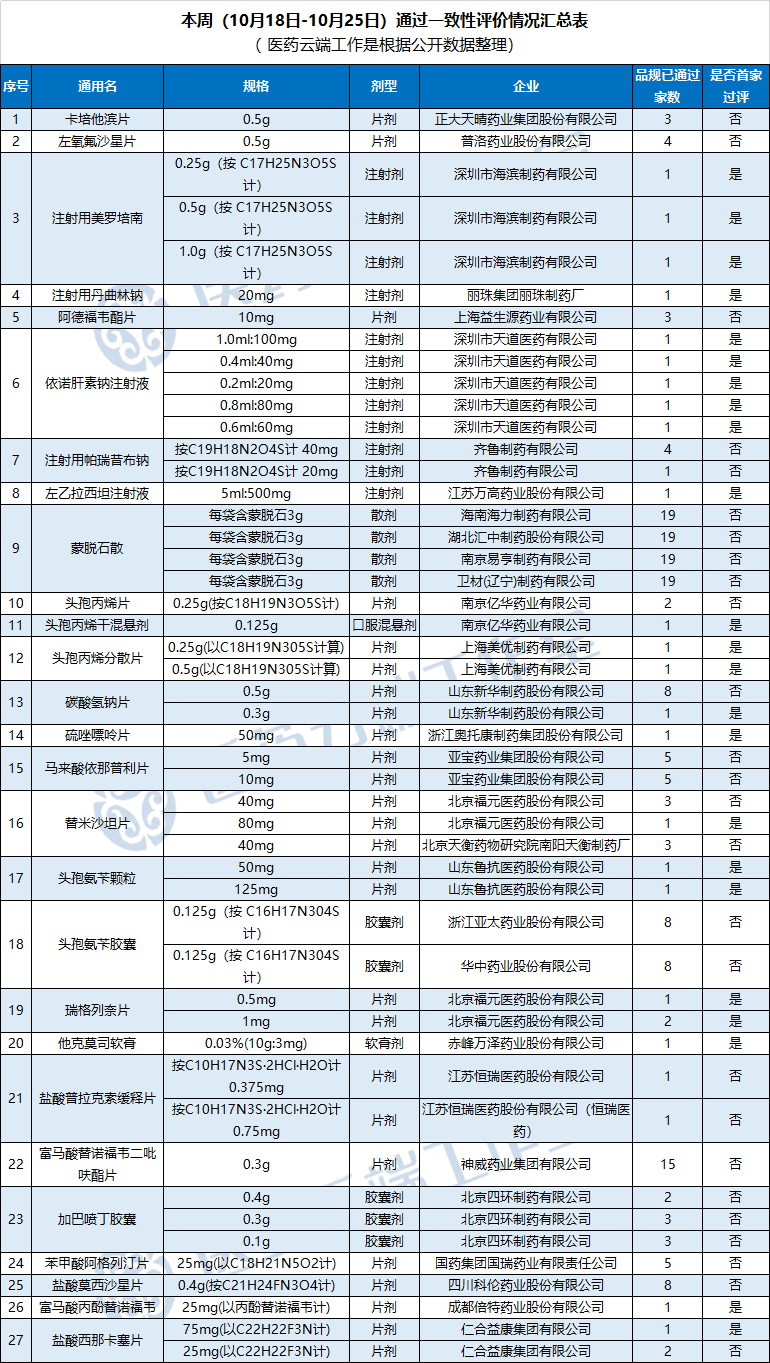
值得注意的是,本期有多款注射剂通过或视同通过一致性评价。其中,齐鲁药业的注射用帕瑞昔布钠,深圳市天道医药的依诺肝素钠注射液以及健康元的注射用美罗培南为通过补充申请的方式通过一致性评价。而在此之前,仅有海南普利的注射用阿奇霉素一款注射剂为通过补充申请方式过评。
齐鲁药业:注射用帕瑞昔布钠通过一致性评价
注射用帕瑞昔布钠是一种镇痛药物,既可静脉注射,又可肌肉注射,可有效满足术后镇痛需快速起效和患者无法进食的临床需求,广泛用于普通外科、妇科、骨科、口腔科等多个科室术后疼痛的治疗。
辉瑞和法玛西亚联合开发的原研产品于2008年在中国获批进口,2016年中国的销售额为7.65亿元。
除齐鲁制药外,国内还有成都百裕制药、杭康药业和宏冠生物药业3家企业按4类申报的注射用帕瑞昔布钠上市申请已经获批,并视同通过一致性评价。
据戊戌数据显示,一致性评价方面,湖南科伦、正大天晴药业、南京正大天晴、上海恒瑞、江苏奥赛康、苑东生物、扬子江药业、海正药业、圣和药业、罗欣药业等10家企业递交了一致性评价补充申请,目前正在审评审批中;另外还有14家企业递交了新注册分类上市申请,可谓竞争非常激烈。
深圳市天道医药:依诺肝素钠注射液通过一致性评价
深圳市天道医药的依诺肝素钠注射液为国内首仿产品,而此次也是国内首家该产品过评企业。
依诺肝素钠注射液原研厂家为赛诺菲,可用于预防静脉血栓栓塞性疾病等。目前,国内还有5家企业正在申请/视同申请该产品一致性评价,包括红日药业、新时代和双鹭药业等。
据米内网数据,2017年中国公立医疗机构终端依诺肝素钠注射液销售额为13.43亿元,同比去年增长29.11%。在抗血栓形成药化药TOP20产品中,依诺肝素钠注射液以5.14%的市场份额排位第三。
健康元:注射用美罗培南(过评)、注射用丹曲林钠(视同)通过一致性评价
近日健康元发布公告称,其全资子公司深圳市海滨制药有限公司收到国家药监局核准签发的《药品补充申请批准通知书》,该药品通过一致性评价。
此外,其控股子公司丽珠医药集团股份有限公司下属全资子公司丽珠集团丽珠制药厂收到国家药监局核准签发的《药品注册证书》,并视同通过一致性评价。
注射用美罗培南
本品适用于成人和儿童由单一或多种对美罗培南敏感的细菌引起的感染:肺炎(包括院内获得性肺炎)、尿路感染、妇科感染(如子宫内膜炎和盆腔炎)、皮肤软组织感染、脑膜炎、败血症。
经验性治疗,对成人粒细胞减少症伴发热患者, 可单独应用本品或联合抗病毒药或抗真菌药使用。
本品单用或与其它抗微生物制 剂联合使用可用于治疗多重感染。对于中性粒细胞减少或原发性、继发性免疫缺陷的婴儿患者,目前尚无本品的使用经验。
注射用丹曲林钠原研品种为美国Par Sterile Products LLC公司的Dantrium®, 该药品最早于1979年在美国获得上市许可批准,用于各年龄段中在伴随合适的支 持性疗法下,控制以恶性高热危象为表现的骨骼肌爆发性代谢亢进。
根据CDE及咸达数据库显示,截至本公告日,国内仅丽珠制药厂取得注射用丹曲林钠注册批件,未见其他厂家申报。
截至本公告披露日,注射用美罗培南一致性评价已累计投入的直接研发费用约为人民币 1521.05 万元。
注射用丹曲林钠
注射用丹曲林钠历经10年研发,是丽珠制药厂自主研发的仿制药,适应症为用于预防及治疗恶性高热。
恶性高热属于罕见病,是一种具有家族遗传性的肌肉病,是主要由挥发性吸入麻醉药和去极化肌松药-琥珀酰胆碱所触发的骨骼肌异常高代谢。在没有特异性治疗药物的情况下,一般的临床降温措施难以控制体温 增高,最终可导致患者死亡。
本产品为国内首仿,丽珠制药厂首次提交本品生产申请的受理时间为2019年2月1日(受理号:CYHS1900135国)。
截止本公告日,注射用丹曲林钠累计直接投入的研发费用约为人民币 1,722.34 万元。
江苏万高药业:左乙拉西坦注射液获批,视同通过一致性评价
左乙拉西坦注射液是抗癫痫药物,用于患者以下症状发作时的辅助治疗:1 月及以上儿童或成人癫痫患者的部分性癫痫发作的加用治疗;12岁及以上青少年或成人癫痫患者的肌阵挛性癫痫发作的加用治疗;6岁及以上儿童或成人患有特发性全身性癫痫发作的原发性强直阵挛发作的加用治疗。
江苏万高药业的左乙拉西坦注射液此次获批,为国内首家过评企业。
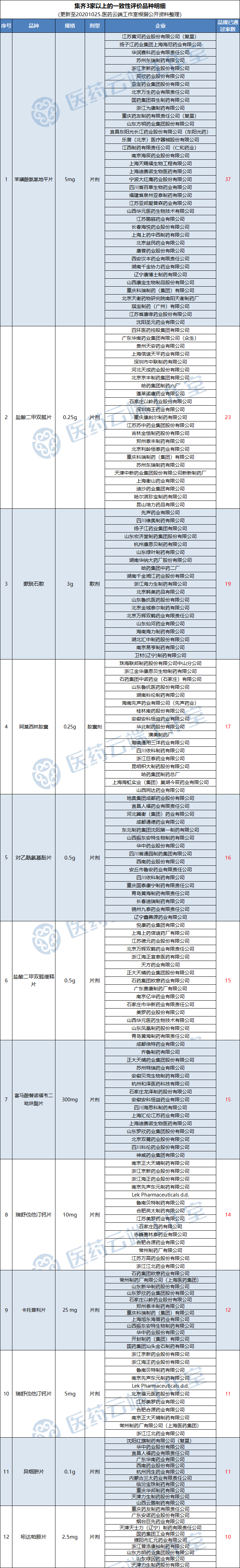
全国最新过评数据通报:目前已有1211个品规通过一致性评价,119个品规集齐三家以上(含三家)过评
据医药云端工作室不完全统计,截止目前,共有1211个品规通过一致性评价。其中119个品规已集齐三家以上过评:
-
苯磺酸氨氯地平片(5mg)已有37个厂家通过 -
盐酸二甲双胍片(0.25g)已有23个厂家通过; -
蒙脱石散(3g)已有19个厂家通过
-
阿莫西林胶囊(0.25g)已有17个厂家通过; -
对乙酰氨基酚片(0.5g)已有16个厂家通过; -
盐酸二甲双胍缓释片(0.5g)、富马酸替诺福韦二吡呋酯片(300mg)已有15个厂家通过; -
瑞舒伐他汀钙片(10mg)已有14个厂家通过; -
卡托普利片(25 mg)、已有12个厂家通过; -
瑞舒伐他汀钙片(5mg)、异烟肼片(0.1g)已有11个厂家通过; -
吲达帕胺片(2.5mg)已有10个厂家通过;
-
格列美脲片(2mg)、头孢呋辛酯片(0.25g)已有9个厂家通过; -
维格列汀片(50mg)、替格瑞洛片(90mg)、盐酸克林霉素胶囊(0.15g)、头孢拉定胶囊(0.25g)、头孢呋辛酯片(0.125g)、头孢氨苄胶囊(0.125g)已有8个厂家通过; -
盐酸左西替利嗪片(5mg)、头孢氨苄胶囊(0.25g)、非那雄胺片(5mg)、盐酸莫西沙星片(0.4g)、阿莫西林胶囊(0.5g)、阿托伐他汀钙片(10mg)、阿哌沙班片(2.5mg)、奥氮平片(5mg)已有7个厂家通过; -
碳酸氢钠片(0.5g)、恩替卡韦片(0.5mg)、他达拉非片(20mg)、枸橼酸托法替布片(5mg)、左乙拉西坦片(0.25g/0.5g)、奥氮平片(10mg)已有6个厂家通过; -
阿托伐他汀钙片(20mg)、恩替卡韦分散片(0.5g)、草酸艾司西酞普兰片(10mg)、盐酸西替利嗪片(10mg)、阿奇霉素片(0.25g)、恩替卡韦胶囊(0.5mg)、吉非替尼片(0.25g)、甲硝唑片(0.2g)、利培酮片(1mg)、奥美沙坦酯片(20mg)、奥氮平口崩片(5mg)、厄贝沙坦片(75mg)、孟鲁司特钠咀嚼片(5mg)、克拉霉素片(0.25g)、利伐沙班片(10mg)、盐酸氨溴索片(30mg)、马来酸依那普利片(5mg)、苯甲酸阿格列汀片(25mg)已有5个厂家通过; -
恩替卡韦分散片(0.5mg)、格列美脲片(1mg)、聚乙二醇4000散(10mg)、厄贝沙坦氢氯噻嗪片(厄贝沙坦150mg/氢氯噻嗪12.5mg)、福多司坦片(0.2g)、辛伐他汀片(20mg)、奥美拉唑肠溶胶囊(20mg)、盐酸帕罗西汀片(20mg)、维生素 B6 片(10mg)、盐酸二甲双胍片(0.5g)、缬沙坦胶囊(80mg)、布洛芬颗粒(0.2g)、恩替卡韦片(1mg)、盐酸曲美他嗪缓释片(35mg)、盐酸曲美他嗪片(20mg)、醋酸阿比特龙片(250mg)、拉米夫定片(0.1g)、硫酸氢氯吡格雷片(75mg)、来那度胺胶囊(25mg)、阿卡波糖片(50mg)、盐酸乙胺丁醇片(0.25g)、阿那曲唑片(1mg)、孟鲁司特钠咀嚼片(4mg)、盐酸坦索罗辛缓释胶囊(0.2mg)、左乙拉西坦注射用浓溶液(5ml:500mg)、注射用紫杉醇(白蛋白结合型)(100mg)、布洛芬注射液(4ml:0.4g/8ml:0.8g)、塞来昔布胶囊(0.2g)、苯甲酸阿格列汀片(25mg)、布洛芬片(0.1g)、草酸艾司西酞普兰片(5mg)、左氧氟沙星片(0.5g)、注射用帕瑞昔布钠(40mg(按C19H18N2O4S计))已有4个厂家过评。



 个人中心
个人中心
 我是园区
我是园区




