今日,武田新一代ALK抑制剂在中国获批上市
收藏
关键词:
上市抑制剂制剂获批
资讯来源:医药观澜 + 订阅账号
发布时间:
2022-03-24
▎药明康德内容团队报道
今日,中国国家药品监督管理局(NMPA)官网最新公示,武田(Takeda)递交的ALK抑制剂布格替尼片(brigatinib)的新药上市申请已获得批准。根据武田早前发布的新闻稿,这是一款新一代强效选择性酪氨酸激酶抑制剂(TKI),旨在靶向作用于间变性淋巴瘤激酶(ALK)分子变异。此前,该产品已在美国、加拿大和欧盟等数十个国家和地区获批上市,治疗特定非小细胞肺癌(NSCLC)患者。

公开资料显示,brigatinib是由ARIAD Pharmaceuticals(于2017年2月被武田收购)研发的新一代TKI,它的设计有针对性地靶向和抑制ALK融合蛋白。非小细胞肺癌是最常见的肺癌类型。研究表明,大约3%~5%的非小细胞肺癌呈现ALK阳性。在这些肿瘤中,患者的ALK基因往往会与其他基因产生融合,生成ALK融合蛋白,这一突变会导致肿瘤生长。作为一款ALK的强效抑制剂,brigatinib能抑制ALK以及ALK融合蛋白,从而抑制肿瘤的生长。
此前,brigatinib曾获得美国FDA授予突破性疗法认定与孤儿药资格,并于2017年获得FDA
加速批准
,治疗ALK阳性转移性非小细胞肺癌患者
,这些患者在接受ALK抑制剂克唑替尼(crizotinib)治疗之后疾病继续进展。2020年5月,该药获得FDA批准扩展适应症,作为单药疗法一线治疗携带ALK阳性晚期非小细胞肺癌患者。
在中国,武田于2021年1月递交了brigatinib的新药上市申请并获得受理。根据中国药物临床试验登记与信息公示平台,目前该产品正在中国开展两项临床试验,一项是针对接受克唑替尼治疗后疾病进展的晚期ALK阳性非小细胞肺癌患者的3期国际多中心临床试验;另一项是针对经ALK抑制剂阿来替尼(alectinib)或塞瑞替尼(ceritinib)治疗后出现疾病进展的ALK阳性晚期非小细胞肺癌患者的2期国际多中心临床试验。
据此推测,本次
brigatinib在中国获批的适应症可能为:克唑替尼治疗后疾病进展的晚期ALK阳性非小细胞肺癌患者。
此前,brigatinib已在针对这一适应症的核心性2期ALTA试验中取得积极结果。
受试者在剂量为90 mg brigatinib每日一次的7天导入期后,分别接受90 mg brigatinib每日一次(n = 112;
A组)或180 mg brigatinib每日一次(n = 110;
B组)的治疗方案。
结果显示,A组主要终点,即研究者评估的经证实的客观缓解率(ORR)为46%,B组为55%;经独立审查委员会(IRC)评估的经证实的ORR为51%,B组为55%。研究者评估的中位无进展生存期(PFS)为9.2个月(A组)和15.6个月(B组);IRC评估的PFS为9.2个月(A组)和16.7个月(B组)。IRC评估显示,基线脑转移可测量的患者中(n=26/n=18,A组/B组),A组中50%和B组中67%的患者获得经证实的颅内客观缓解。该研究
数据也表明,在晚期ALK阳性非小细胞肺癌患者中,brigatinib适用于克唑替尼难治性人群的疗效和安全性。
我们也期待此次brigatinib在中国获批,能够为更多非小细胞肺癌患者带来新的治疗选择。
参考资料:
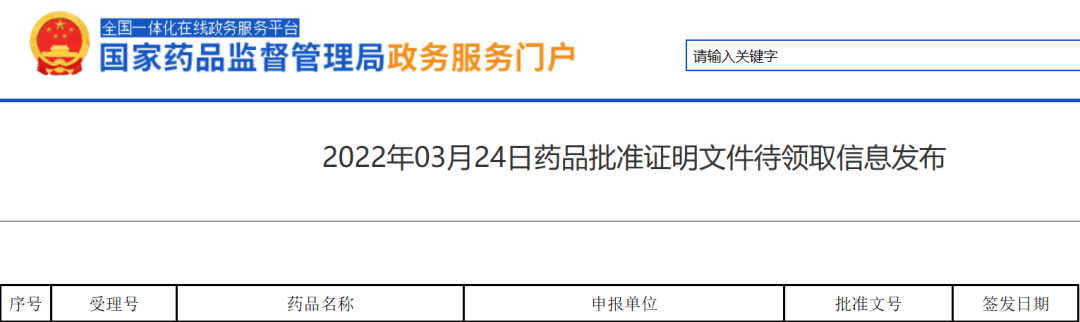
[1] 2022年03月24日药品批准证明文件待领取信息发布.Retrieved Mar 24,2022.From https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20220324160221168.html
[2] 美国FDA批准武田ALUNBRIG® (brigatinib)用于ALK+转移性非小细胞肺癌患者的一线治疗. Retrieved Oct 19, 2017, from https://mp.weixin.qq.com/s/6sf2WPY8t1K74rDDqe5VAg
[3]武田公布肺癌药物ALUNBRIG™在ALK阳性非小细胞肺癌中的核心性2期ALTA试验最新结果. Retrieved Oct 19, 2017, from https://mp.weixin.qq.com/s/H-sYyd98l6axKICcBzyA8w
本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。








 个人中心
个人中心
 我是园区
我是园区




