
磷脂是组成细胞膜与内膜系统的主要成分,其化学结构主要包括甘油骨架,连接于甘油两个羟基(sn1和sn2)之上的两个酰基链以及通过磷酸基团与甘油第三个羟基(sn3)相连的极性头部。动物体内主要通过被称为Kennedy通路的从头合成方式来产生磷脂分子【1】,该通路产生的新生磷脂分子主要携带中短链的饱和或单不饱和酰基链,与细胞膜上大量存在的多不饱和长链磷脂相去甚远。为实现新生磷脂向成熟膜磷脂的转化,细胞利用被称为Lands循环的磷脂重塑过程来对新生磷脂进行编辑,通过对磷脂的酰基进行擦除(去酰基化)和重新写入(再酰基化)来将多不饱和长酰基链引入磷脂【2】。新生磷脂经酰基“擦除”后产生溶血磷脂,此后由多种溶血磷脂酰基转移酶来实现酰基的重新“写入”。作为磷脂的主要成分,磷脂酰胆碱的重塑,特别是其sn2位上发生的酰基写入,是磷脂重塑的一个关键步骤,这一过程主要由3型溶血磷脂酰胆碱酰基转移酶(LPCAT3)来催化完成【3】。与其它溶血磷脂酰胆碱酰基转移酶(例如LPCAT1和2)相比,LPCAT3特异性地识别并催化多不饱和酰基转移反应(例如20:4、18:2酰基等),是磷脂重塑的主力代谢酶【4】。LPCAT3功能受损可导致多种代谢异常,例如动脉粥样硬化和非酒精性脂肪肝等。
LPCAT3是定位于内质网膜的多跨膜蛋白,属于膜结合酰基转移酶超家族(MBOAT),该超家族包括多种重要代谢酶类,例如向二酰基甘油“写入”酰基的二酰基甘油酰基转移酶(DGAT)【5, 6】、向胆固醇“写入”酰基的固醇酰基转移酶(SOAT)【7, 8】与溶血磷脂酰胆碱酰基转移酶(LPCAT)等。迄今为止,对于MBOAT家族催化脂类酰化的机制研究尚有多个谜团有待揭开,例如此前对DGAT1和SOAT1的研究均指出了酰基供体分子的结合方式,而对于酰基受体脂类分子如何进入反应中心并参与反应,尚无结构上的直接证据。此外,由于LPCAT3蛋白特异性地选择多不饱和酰基作为底物,其区分饱和酰基与多不饱和酰基的能力如何产生仍是一个领域内待解的谜题。
2021年11月25日,上海交通大学医学院附属第九人民医院曹禹研究员所带领的团队在Nature Communications杂志上在线发表题为The structural basis for the phospholipid remodeling by lysophosphatidylcholine acyltransferase 3的研究论文,通过冷冻电镜、X射线晶体学与生物化学方法,首次完成了对LPCAT3蛋白在空载状态、酰基供体底物结合态与酰基受体底物结合态下多重构象解析工作,在亚原子尺度上还原了磷脂重塑的关键催化过程,并揭示了LPCAT3如何“挑选”多不饱和碳链的结构基础。

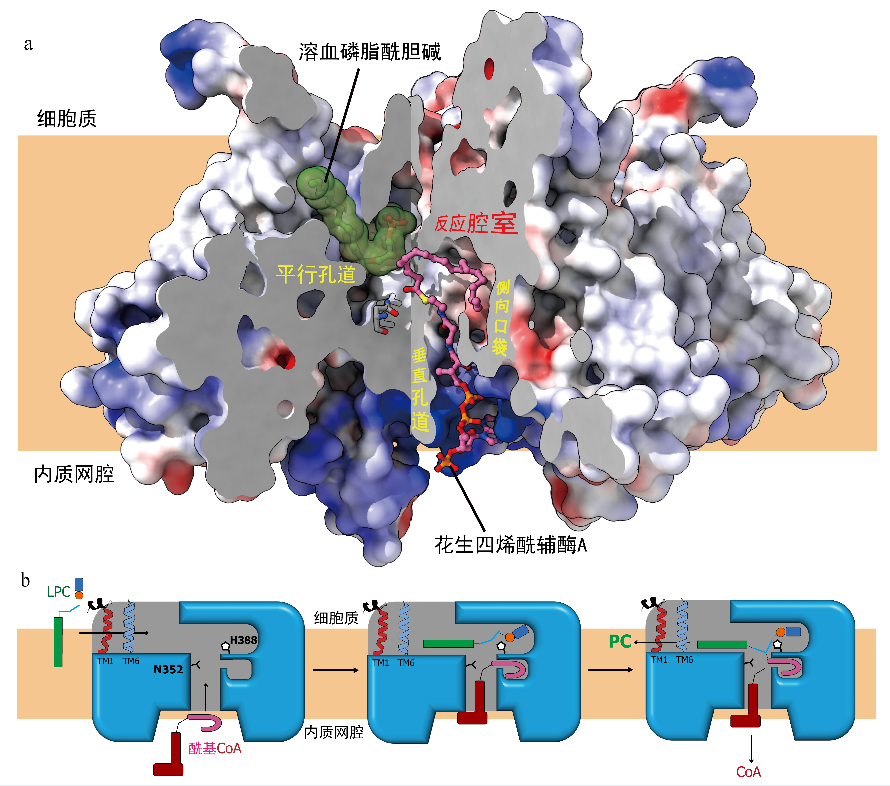
LPCAT3在晶体结构中呈单体状态,分析可见跨膜区内形成了中空的反应腔室(图1a)。该腔室从平行于内质网膜的角度来看呈“T”型,包含一个平行于脂膜的平行孔道和一个与平行孔道大致成直角的垂直孔道,其中垂直孔道一端向内质网腔开放,另一端连接于平行孔道的中部,并在连接处下方形成一个侧向口袋。为进一步探索在反应腔室中发生的生化反应细节,曹禹团队进一步利用冷冻电镜方法解析了处于花生四烯酰辅酶A(酰基供体)结合状态和处于溶血磷脂酰胆碱LPC(酰基受体)结合状态下的LPCAT3结构(图1b与c)。

冷冻电镜分析显示LPCAT3可以形成同二聚体复合物,其中LPC分子结合于平行孔道之中,而花生四烯酰辅酶A分子则通过垂直孔道插入反应腔室。将两个底物结合态构象进行叠加分析显示,酰基受体与供体底物分子占位并不重叠(图2a),并且二者在T型腔室的平行-垂直孔道接合处相遇,在该处存在的催化残基H388与N352的作用下,完成花生四烯酰基团向溶血磷脂酰胆碱的sn2羟基上的“写入”,最终产生重塑磷脂酰胆碱。此外,在晶体结构中发现的侧向口袋“迫使”垂直孔道中结合的酰基链折叠形成弯环结构,否则较长的酰基链将受到强烈的空间位阻作用从而无法参与反应。侧向口袋形成的弯环结构正符合多不饱和碳链在热力学上最为稳定的构型,这也是LPCAT3能够特异性地催化多不饱和酰基“写入”溶血磷脂的关键。
该项工作通过多构象代谢酶结构的解析,成功地在亚原子尺度还原了磷脂再酰基化的反应过程并揭示了其对多不饱和底物的选择机制,为人们理解磷脂重塑的分子机制迈出了关键一步,也为针对LPCAT3进行的药物开发奠定了结构基础。同时,该项工作也提出了一些新的问题。文章中的结构研究与生化分析均提示LPCAT3可能与已报道的MBOAT超家族蛋白呈相反的跨膜拓扑结构,即LPCAT3可能具有向内质网腔开放的酰基辅酶A结合孔道。考虑到动物细胞中多数酰基辅酶A合成酶类(例如长链脂肪酸-CoA连接酶)的催化结构域定位于细胞质侧,本文的结果提示在内质网上有可能存在负责跨内质网膜转运长不饱和酰基辅酶A的分子系统,该系统负责将细胞质内形成的酰基辅酶A运入内质网腔来参与溶血磷脂再酰基化反应。这一推论是否成立,以及如果成立负责转运的分子的具体身份是什么,是值得进一步探索的问题。
本项研究的通讯单位是上海交通大学医学院附属第九人民医院精准医学研究院与骨科,通讯作者为曹禹研究员。中国科学院分子细胞科学卓越创新中心的张庆同学、上海交通大学医学院附属第九人民医院的饶兵博士和上海交通大学医学院附属仁济医院的姚德强博士为该论文的共同第一作者。本研究由曹禹课题组同上海第九人民医院雷鸣课题组、骨科赵杰与秦安课题组、上海复旦大学药学院周璐课题组以及纽约城市大学的蒋宪成实验室合作完成。
曹禹课题组目前诚邀博士后/研究助理加入开展蛋白质与脂代谢研究,有意者请访问曹禹实验室主页(http://www.shipm.cn/jyjz_web/html/DefaultSite/jyjz_syxz_cy_jrwm/List/index.htm)或来信咨询。
参考文献
[1]KENNEDY E P, WEISS S B. The function of cytidine coenzymes in the biosynthesis of phospholipides [J]. J Biol Chem, 1956, 222(1): 193-214.
[2]LANDS W E. Metabolism of glycerolipides; a comparison of lecithin and triglyceride synthesis [J]. J Biol Chem, 1958, 231(2): 883-8.
[3]YANG Z, YAN-QUN C, TABETHA M B, et al. Identification and characterization of a major liver lysophosphatidylcholine acyltransferase [J]. Journal of Biological Chemistry, 2008.
[4]HISHIKAWA D, SHINDOU H, KOBAYASHI S, et al. Discovery of a lysophospholipid acyltransferase family essential for membrane asymmetry and diversity [J]. Proc Natl Acad Sci U S A, 2008, 105(8): 2830-5.
[5]SUI X, WANG K, GLUCHOWSKI N L, et al. Structure and catalytic mechanism of a human triacylglycerol-synthesis enzyme [J]. Nature, 2020, 581(7808): 323-8.
[6]WANG L, QIAN H, NIAN Y, et al. Structure and mechanism of human diacylglycerol O-acyltransferase 1 [J]. Nature, 2020, 581(7808): 329-32.
[7]LONG T, SUN Y, HASSAN A, et al. Structure of nevanimibe-bound tetrameric human ACAT1 [J]. Nature, 2020, 581(7808): 339-43.
[8]QIAN H, ZHAO X, YAN R, et al. Structural basis for catalysis and substrate specificity of human ACAT1 [J]. Nature, 2020, 581(7808): 333-8.
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




