▎药明康德内容团队编辑
今日Immunocore宣布,美国FDA授予其创新T细胞受体(TCR)疗法tebentafusp(IMCgp100)突破性疗法认定,用于治疗不可切除性或转移性葡萄膜黑色素瘤(mUM)成人患者,这些患者为HLA-A*02:01阳性。新闻稿指出,如果获得批准,tebentafusp将是40年来治疗转移性葡萄膜黑色素瘤的首个新疗法。

Tebentafusp创新地将靶向肿瘤抗原的TCR与能够和CD3受体结合的免疫效应结构域(immune-effector domain)联合到一起。依照设计,该双特异性蛋白能引导和激活T细胞,让它们识别和杀死癌细胞。Tebentafusp特异性靶向gp100,它是在黑色素细胞和黑色素瘤中表达的抗原。
值得关注的是,该公司的相应技术能让TCR以高亲和力识别细胞内的癌症抗原,这有望突破现有抗体类药物的局限,将可识别的靶点数量从10%增加到90%。此外,基于现有的T细胞浸润人类肿瘤的机制,Immunocore也指出,其TCR技术有望用于治疗免疫学上的“冷肿瘤”,即突变率不高,传统上难以引起免疫系统注意的肿瘤。
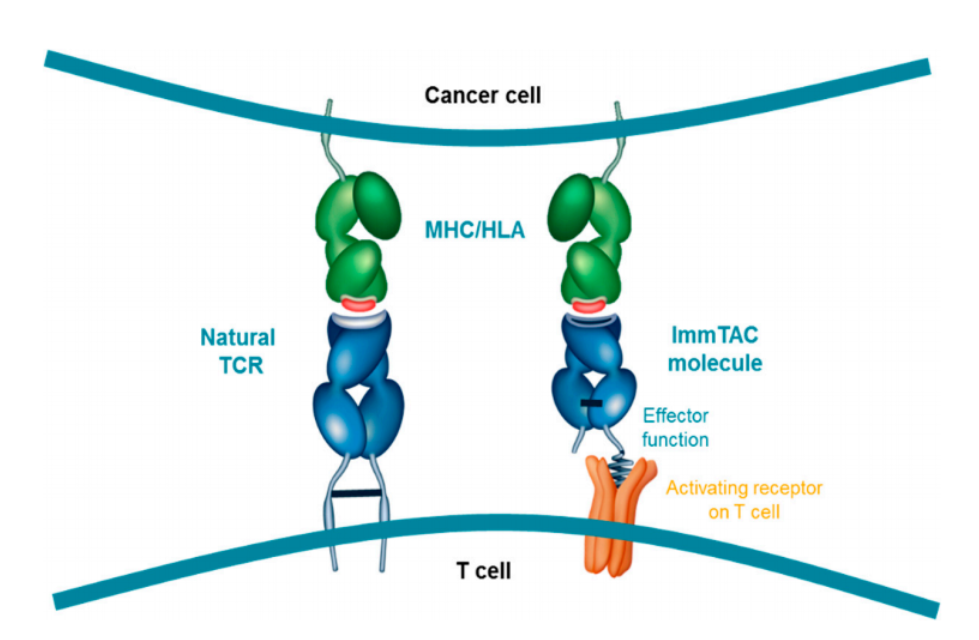
▲此类TCR疗法的设计,模拟了天然的TCR作用机制(图片来源:参考资料[2])
这一突破性疗法认定是基于在2020年11月公布的3期临床试验结果。中期分析显示,在治疗初治转移性葡萄膜黑色素瘤患者时,与研究人员选择的其他疗法相比(包括dacarbazine、ipilimumab或pembrolizumab),tebentafusp表现出显著生存获益。尽管目前数据尚未完全成熟,但tebentafusp组目前的一年生存率为73%,优于其他疗法组的58%。

▲Immunocore首席执行官Bahija Jallal博士今年在2021药明康德全球论坛上分享加速医药研发方面的洞见
Immunocore首席执行官Bahija Jallal博士表示:“我们很高兴FDA基于3期临床试验的生存获益,授予tebentafusp突破性疗法认定。目前患者迫切需要治疗这种罕见侵袭性黑色素瘤的方法,我们期待继续与监管机构合作,尽快将tebentafusp带给患者。”




 个人中心
个人中心
 我是园区
我是园区




