您还不是认证园区!
赶快前去认证园区吧!

7月18日,Celcuity宣布其PI3K/mTOR抑制剂gedatolisib被FDA授予突破性疗法认证,用于治疗接受CDK4/6疗法和非甾体类芳香酶抑制剂治疗期间疾病仍然进展的HR+/HER2-转移性乳腺癌患者。Gedatolisib是一种潜在的first-in class泛PI3K/mTOR抑制剂,此前于2022年1月获FDA快速通道认证。

HR+/HER2-转移性乳腺癌患者通常接受内分泌治疗,如他莫昔芬,来曲唑或氟维司群,但是大多数患者容易对这些内分泌疗法产生耐药性。Gedatolisib是一种有效的、可逆的双重抑制剂,可选择性地靶向所有I类PI3K亚型(p110α、p110β、p110γ和p110δ)和mTOR,极大地避免了耐药性的产生。
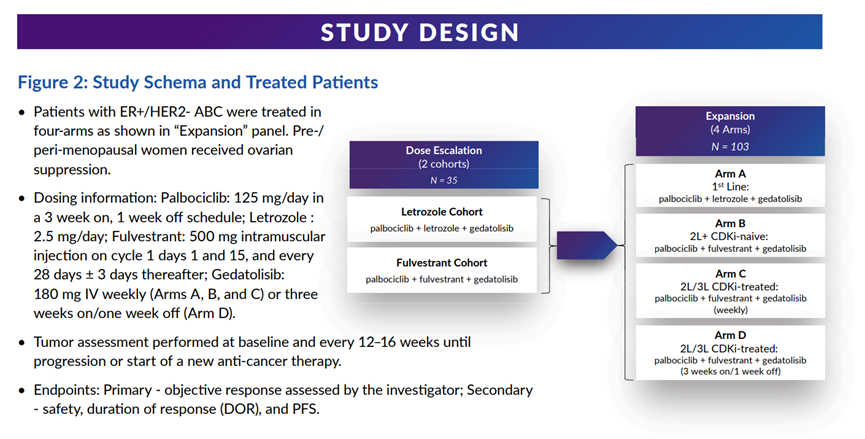
Gedatolisib的突破性疗法认证是基于一项Ib期研究(n=103)的数据。该研究评估了gedatolisib联合CDK4/6抑制剂(哌柏西利)与现有内分泌疗法(氟维司群)在接受CDK4/6疗法和非甾体类芳香酶抑制剂治疗期间疾病仍然进展的HR+/HER2-转移性乳腺癌患者中的安全性、耐受性和疗效。主要评估标准为客观缓解率(ORR)。
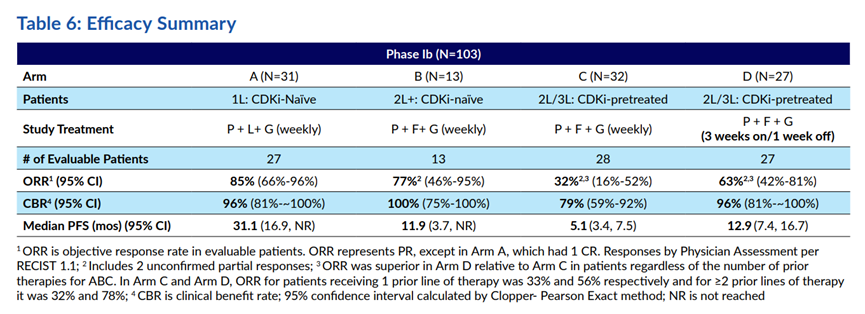
结果显示,相对于历史对照数据,不同组别患者的ORR普遍改善。Celcuity预计在今年启动一项III期试验,评估gedatolisib在HR+/HER2-晚期乳腺癌患者中的疗效。
Celcuity首席执行官兼联合创始人Brian Sullivan说: “突破性疗法的认证是gedatolisib和在CDK4/6抑制剂治疗期间疾病仍然进展的转移性乳腺癌患者的重要发展里程碑。 这些患者迫切需要新的治疗选择。 我们期待与FDA继续合作,努力推进gedatolisib的开发。 ”



 个人中心
个人中心
 我是园区
我是园区





