FDA近日宣布2023财年将向国会申请84亿美元的预算,用于核心食品安全和医疗产品安全计划、关键公共卫生现代化以及其他重要公共卫生基础设施等方面。这比2022财年的财政拨款增加近34%(21亿美元),FDA局长 Robert M. Califf 医学博士强调:“今年FDA预算请求中概述的资金对于FDA履行使命至关重要,因为我们将继续开展广泛的COVID-19和其他优先事项的工作。更多的资金带来了新的方式,利用基于科学的可靠信息来保护和促进每个美国人的健康。”
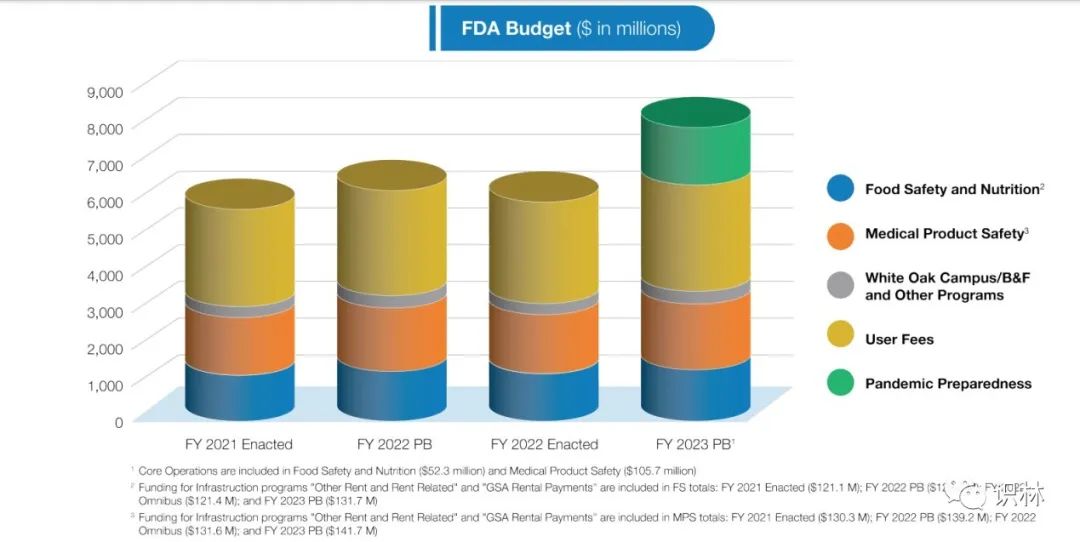
FDA历年预算结构概览
84亿美元的预算,打算花在哪里?
防范流行病
FDA将利用这笔款项,通过构建分析和预测建模能力来加强个人防护设备供应链,加速诊断方法的开发,并支持与国际合作伙伴加强外国检查,协调治疗和诊断的上市前审查,并减少人畜共患病病原体蔓延。
推进医疗产品安全
预算新增9500万美元用于保障医疗产品安全。款项去向包括:继续发展供应链监控和弹性规划,改进对已上市产品的药品安全监督,加快FDA动物药物审评和进一步推动医疗行业减少动物试验,加强医疗设备网络安全的保障。其中,大笔投入将用于阿片类药物危机和癌症。
投资核心业务
预算增加1.58亿美元支持跨部门的协作,提供资源、技术、能力和基础设施以满足公共卫生需求,应对全球食品和医疗进步带来的复杂挑战、产品技术和供应链相关事项。
6800万美元用于进一步投资数据现代化和增强技术。该预算增加了与食品和医疗产品计划以及关键企业技术能力相一致的核心计划和基础设施;人工智能、机器学习和区块链等提升数据知情能力的投入。数据现代化还将使FDA能够更快地审查大量数据,识别关键的安全信号或新出现的疫情。
2400万美元用于优化检查和提高检查能力。预算请求增加对招募和培训新的FDA调查员的支持,以提高该机构的人和动物的食品和医疗产品检验业务的效率。
500万美元的新资金用于产品测试的新替代方法的综合战略。如:开发适当的替代方法来减少动物试验等。
用户费用
30亿美元用于履行保护公众健康的承诺,提高效率,加快向公众提供产品的速度。其中1亿美元将帮助FDA加强烟草制品的合规和执法工作,保护消费者免于烟草的危害。
基础设施、建筑物和设施现代化
新增4000万美元用于维护和租赁FDA的实验室和现场基础设施,改善功能,提高可靠性。
加强食品安全和营养
7600万美元的新资金用于把资源集中在食品上,针对最脆弱人群(婴儿、学步儿童和孕妇和哺乳期妇女)的营养问题。
预算还将用于下列立法
修改180天专营期条款以鼓励首仿及时上市
鉴于实践中存在180天专利挑战的专营期会被第一申请人占用,批准后很长一段时间不进行营销而形成“搁置“,使得鼓励早期仿制药进入市场的预期无法达成。
FDA提议修改《联邦食品、药品和化妆品法案》(FD&C 法案)的第 505(j)(5)(B)(iv) 和 (D)(i)-(iii) 节,明确 FDA可以批准后续的仿制药申请,除非首仿申请人已开始180天的商业营销。立法提案以竞争性仿制药计划(CGT,该制度是通过2017年FDA重新授权法案,适用于仿制药竞争不足且在最初提交ANDA时橙皮书中没有未到期专利或独占权的药物)为蓝本制定了首仿专营期新的规定:“指定FDA可以批准后续申请,除非第一个申请人开始药物的商业营销,届时后续申请的批准将搁置180天(即从第一个申请人的首次商业营销之日起至180天后),确保专营期实际上持续180天,而不是根据现行法律可能持续多年。”FDA认为这可以增加专利保护药物的仿制药版本及时进入市场的可能性,并且使多个版本的仿制药产品将迅速获得批准,从而显著节省成本。不过,一些利益相关的人士指出,FDA着眼的是等式的错误一端。真正有意义的不是从ANDA批准到上市的时间,而是要关注专利期的结束时间,提前做好上市准备。
确保验证性研究的可行性和及时性,完善加速审批处方药的撤回程序
FD&C法案中没有为FDA提供有效的法律授权来解决加速审批药物验证性研究进展太慢的问题。而及时进行验证性研究,获得高质量、可解释的结果将有利于FDA对加速审批药物进行监管,最大限度缩短其在其临床效益得到确证之前的上市时间。
为此,FDA提议:1) 修改 FD&C 法案的第 506(c)(2)(A) 节,以便 FDA 可要求申请人提交备案,作为加速批准的条件,先证明批准后的确认性研究的设计足以验证和描述临床益处,并能尽快完成;2) 修改第 506(c)(3) 节,以便 FDA 在撤回药品加速批准时,申请人可以遵循其药物申请的争议解决程序;3) 对FD&C 法案 506(c)(3)(C) 中的退出标准进行修订,参照第 505(e) 节中针对传统批准药物的类似退出标准。
授权FDA要求责任方销毁构成重大公共卫生风险的进口产品
FDA 要求修订FD&C法案第 801 条,以授权FDA要求所有者或收货人销毁任何已被拒绝并存在重大公共卫生问题的FDA监管产品,同时取消他们根据现行第 801(a) 条享有的出口此类产品的选择权。FDA 认为这一新的授权将降低此类产品被重新进口的风险,减少海关和边境保护局(CPB)与FDA的协调,从而提高效率。此外还要求销毁费用由相应的进口商预先支付,如此 FDA 和 CBP 就不必提起法律诉讼来收回销毁费用。
扩展FDA工具范围以对 FDA 监管的产提供监督
FDA要求修订(FD&C 法案)第 704(a)(4) 条,针对包括医疗器械、食品、烟草产品和化妆品企业在内的监管对象,明确生物医学研究监测 (BIMO) 检查的适用性。增加FDA与企业进行远程监管评估的明确授权,包括远程交互式评估,例如操作直播视频、电话会议和屏幕共享。在现场检查和调查受到限制的情况下,提高FDA的审评效率。
延长有效期以缓解严重的药物短缺
由于一些临床急需药品设置了过短的保质期,导致由于“过期”被丢弃,加剧了这类药品的短缺。该提案将扩大FDA的权力,在可能减轻短缺的情况下,要求申请人评估并向FDA提交研究,确定具有科学合理性的最长有效期(保质期)。该提案还寻求授权FDA在申请人不遵守规定的情况下征收民事罚款。
此外,还有下列法规提案。在此仅列出名称,可在FDA网站或识林查阅具体内容。
医疗器械网络安全
医疗器械短缺
膳食补充剂健康和教育法案的现代化修订
更新立法机关并授权化妆品注册费
加强FDA的权力以更好地保护婴幼儿
婴幼儿食用食品的产品检测要求
烟草使用者收费框架的现代化
加强各州信息披露
预防食物短缺,包括婴儿配方奶粉和某些医疗食品
作者:识林-白蜡


长按下方二维码下载识林®App

识林®版权所有,未经许可不得转载。



 个人中心
个人中心
 我是园区
我是园区




