「 本文共:16条资讯,阅读时长约:3分钟 」




1.君实核苷类新冠药上Ⅲ期临床。君实生物旗下君拓生物与旺山旺水合作开发的口服核苷类抗SARS-CoV2药物VV116片,在治疗中重度COVID-19患者的国际III期临床首例患者入组及给药。临床前研究显示,VV116有较高的口服生物利用度和良好的化学稳定性;在体内外具有显著的抗SARS-CoV-2作用,对SARS-CoV-2原始株和已知重要变异株(Alpha、Beta、Delta和Omicron)均表现出抗病毒活性。
2.济民可信镇痛新药获批临床。济民可信旗下子公司上海济煜自主研发的高选择性离子通道阻滞剂JMKX000623获国家药监局临床试验默示许可,拟开发用于疼痛的治疗。JMKX000623通过阻滞钠离子内流而阻止痛觉发生和传递,有望为各种疼痛患者提供治疗上的有效缓解。在临床前研究中,该新药在多个动物疼痛模型中均显示出显著的镇痛作用,而且体外安全性和耐受性数据良好。
3.诺华干眼症创新药在华获批临床。诺华5.1类新药lifitegrast滴眼液获国家药监局临床试验默示许可,拟用于治疗干眼的体征和症状。这是诺华从武田购进的一款干眼病创新治疗产品,主要成分为5.0%浓度的lifitegrast,能够抑制LFA-1与ICAM-1的结合,从而减少由T淋巴细胞介导的炎症水平。该新药目前已在美国、加拿大、澳大利亚等多个国家获批上市,是首个获批通过抑制干眼症引起的炎症来治疗干眼症的处方药。
4.复宏汉霖PD-L1/TIGIT双抗获批临床。复宏汉霖重组人源抗PD-L1/TIGIT双抗HLX301获国家药监局临床许可,拟用于治疗局部晚期/转移性实体瘤或淋巴瘤。在临床前研究中,与PD-L1单抗、TIGIT单抗以及两种单抗的联合治疗对比,HLX301通过与PD-L1和TIGIT特异性结合,阻断PD-1/PD-L1和TIGIT/PVR负向信号通路,抑制了肿瘤细胞的生长,并显示出协同增强效应。目前HLX301正在澳大利亚开展Ⅰ期临床。
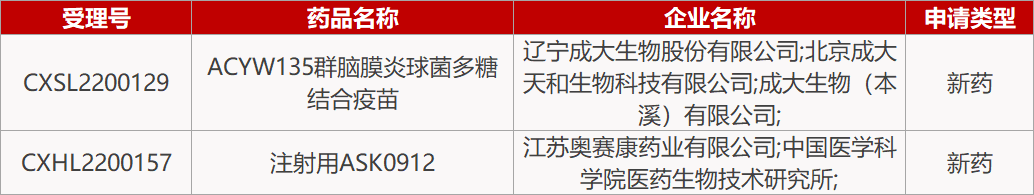
5.奥赛康抗G-耐药菌新药报IND。江苏奥赛康1类化药注射用ASK0912的临床试验申请获NMPA受理。ASK0912是该公司与中国医学科学院医药生物技术研究所合作开发的新型抗菌药物,对临床严重耐药的革兰氏阴性菌(G-)具有广谱活性,多项体内外药效研究显示抗菌活性强于多黏菌素B和E,并且毒性降低。ASK0912有望成为活性更强、安全性更好的抗G-耐药菌的治疗选择。
6.德国默克与思路迪达成临床研究合作。德国默克EGFR抑制剂西妥昔单抗拟与思路迪医药皮下注射PD-L1恩沃利单抗开展临床研究,评估联合用药在RAS/BRAF野生型、非MSI-H/pMMR且经氟尿嘧啶类、奥沙利铂和伊立替康以及贝伐珠单抗治疗失败的转移性结直肠癌患者中的效果。恩沃利单抗已获NMPA批准上市,用于治疗不可切除或转移性MSI-H/dMMR晚期实体瘤。前期研究显示该药与西妥昔单抗的联用具有抗肿瘤协同作用。


1.糖尿病创新治疗模式关键临床积极。Better公司潜在“first-in-class”的处方数字化治疗(PDT)平台BT-001与标准治疗联用,在治疗2型糖尿病的关键临床获积极结果。与标准治疗相比,BT-001联合标准治疗90天后,患者的平均糖化血红蛋白(A1c)水平显著降低0.4%,两组A1c降低0.4%或以上的患者比例分别为42.7%和25.4%(差异为17.3%,p<0.001)。而且两组的安全性相似。Better计划向FDA提交上市申请。
2.多肽疫苗抗AD临床积极。Grifols旗下Araclon Biotech公司多肽疫苗ABvac40用于治疗失忆性轻度认知障碍和非常轻度阿尔茨海默病患者的Ⅱ期临床第一部分结果积极。6剂ABvac40疫苗接种后,显著升高患者的抗Aβ40特异性抗体水平,高于在Ⅰ期临床中3剂接种后观察到的水平。ABvac40的安全性与安慰剂相似。目前,研究人员正在评估探索性疾病生物标志物的变化,以及ABvac40对认知和生活质量的影响。
3.Moderna第二款艾滋病mRNA疫苗上临床。Moderna公司开发的基于HIV衣壳蛋白三体(trimer)表达的mRNA疫苗mRNA-1574,在Ⅰ期临床中完成首例志愿者给药。该项试验旨在评估mRNA-1574用于未被HIV病毒感染的受试者中的安全性和耐受性,以及免疫原性。去年8月,该公司另一款HIV疫苗mRNA-1644已经启动首次人体临床试验,预计2023年春季获得结果。据悉,全球范围内大约有3800万人受到HIV病毒的感染。
4.Nuravax两款AD疫苗将上临床。Nuravax公司拟用于预防性治疗阿尔茨海默病(AD)的两款疫苗(DNA疫苗AV-1959D和重组蛋白疫苗AV-1959R)即将启动Ⅰ期临床试验。这两种疫苗是基于Nuravax公司的MultiTEP疫苗平台设计,同时靶向Aβ的多个B细胞和T细胞表位。Nuravax拟开发AV-1959D作为第一针,AV-1959R作为加强针,旨在激发高水平的抗体,抑制Aβ聚集,延缓有患病风险人群中疾病的发生。
5.赛诺菲联合黑石推进骨髓瘤创新疗法。赛诺菲与黑石生命科学(Blackstone Life Sciences)达成一项战略性合作,黑石生命科学将支付高达3亿欧元,用于支持赛诺菲2022年下半年启动国际关键研究和临床开发项目,以评估抗CD38抗体Sarclisa(isatuximab)皮下制剂配方,用于治疗多发性骨髓瘤(MM)患者。根据协议,黑石生命科学将有资格获得未来产品销售的特许权使用费。
6.渤健获得AD药物Aduhelm完全决策权。Biogen与卫材宣布修订双方关于阿尔茨海默病新药Aduhelm(aducanumab-avwa)的合作协议。自2023年1月1日起,卫材将根据Aduhelm的净销售额获得分层特许权使用费,而非共享全球利润和损失。特许权使用费率将从2%开始,当年销售额超过10亿美元时为8%。从3月14日起,渤健将独立负责Aduhelm的开发决策和商业化。


1.抗原检测不能代替核酸检测。3月15日,国家卫健委临床检验中心副主任李金明在新闻发布会上强调,核酸检测是确定新冠肺炎感染的“金标准”,抗原检测不能代替核酸检测。目前,我国已获批上市的抗原检测试剂的敏感性在75%~98%,特异性在95%~99%。李金明表示,抗原检测应该用在高风险、高流行率的聚集性感染的人群检测,一般人群不要随意做抗原检测。
2.无偿献血表彰奖项和标准调整。近日,国家卫健委、中国红十字会总会等部门联合发布《全国无偿献血表彰奖励办法(2022年版)》。新版《奖励办法》增加“无偿献血奉献奖终身荣誉奖”奖项,获奖标准为“累计获得无偿献血奉献奖金奖3次以上者”,终身荣誉奖仅表彰一次;调整了“无偿献血志愿服务奖”获奖标准,并将“造血干细胞捐献志愿服务时间”纳入评选条件;调整了“无偿献血先进省(市)奖”获奖标准。
3.国家发布第九版《新冠肺炎诊疗方案》。3月15日,国家卫健委发布新冠肺炎诊疗方案(试行第九版)。新版方案在核酸检测基础上增加了抗原检测作为补充,旨在提高病例早发现能力;对病例实施分类收治,轻型病例实行集中隔离管理;将两种特效药(Paxlovid和安巴韦单抗/罗米司韦单抗注射液)纳入诊疗方案;调整解除隔离管理及出院标准的核酸检测指标,并将“出院后继续进行14天隔离管理和健康状况监测”修改为“解除隔离管理或出院后继续进行7天居家健康监测”。




【智飞生物】全资子公司智飞绿竹的23价肺炎球菌多糖疫苗申请生产注册获得《受理通知书》。
【康泰生物】全资子公司民海生物收到关于无细胞百白破b型流感嗜血杆菌联合疫苗的《药品再注册批准通知书》。
【君实生物】控股子公司君拓生物与旺山旺水合作开发的VV116治疗中重度COVID-19的III期临床研究完成首例患者给药。
【我武生物】“黄花蒿花粉变应原舌下滴剂”完成了“黄花蒿花粉变应原舌下滴剂对成人变应性鼻炎患者的长期疗效和安全性评价——多中心、开放性临床试验”的首例受试者入组。
- The End -





 个人中心
个人中心
 我是园区
我是园区




