▎药明康德内容团队编辑
2021年7月8日,安进(Amgen)和阿斯利康(AstraZeneca)联合宣布,美国FDA已受理了双方共同开发的抗胸腺基质淋巴细胞生成素(TSLP)单克隆抗体疗法tezepelumab的生物制品许可申请(BLA),用于治疗哮喘。FDA同时授予这一BLA优先审评资格,预计在2022年第一季度做出回复。

全球估计有3.39亿哮喘患者,大约10%患有重度哮喘。尽管使用了吸入性哮喘控制药物,许多重度哮喘患者的症状仍未得到控制。由于重度哮喘的复杂性,许多患者具有不明确或多种炎症驱动因素,可能不符合使用当前生物制品的条件或对其反应不佳。
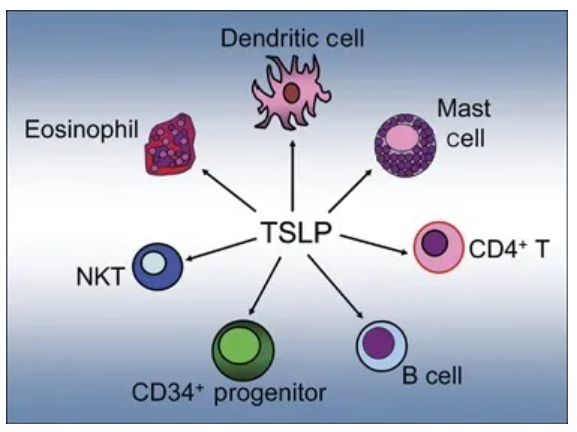
Tezepelumab是一种潜在“first-in-class”药物,可阻断TSLP的作用。TSLP是一种上皮细胞因子,位于多个炎症级联反应的顶端,启动过敏性、嗜酸性粒细胞和其他类型与严重哮喘相关的气道炎症的过度免疫反应。美国FDA于2018年9月授予tezepelumab突破性疗法认定,用于治疗无嗜酸性粒细胞表型的重度哮喘患者。
▲TSLP对多种免疫细胞的免疫反应产生影响(图片来源:参考资料[2])
此次BLA是基于名为PATHFINDER的临床开发项目,包括关键性
的结果。NAVIGATOR试验结果于2021年5月发表在《新英格兰医学杂志》上。试验结果显示,在治疗症状未受控制的重度哮喘患者时,tezepelumab达到试验所有主要终点和关键性次要终点。与安慰剂相比,将每年哮喘急性加重率(AAER)降低56%(p<0.001)。
“对于医生和数百万患者来说,严重哮喘是一种具有挑战性的复杂疾病,具有高度未满足的医疗需求,”安进研发执行副总裁David M. Reese博士说,“Tezepelumab代表了广泛的重度哮喘患者群体的一种潜在的变革性治疗选择。我们期待尽快将它带给患者。”
参考资料:
[1] Tezepelumab Granted Priority Review By U.S. FDA. Retrieved July 8, 2021, from https://www.prnewswire.com/news-releases/tezepelumab-granted-priority-review-by-us-fda-301327578.html
[2] Comeau & Ziegler. (2009). The influence of TSLP on the allergic response. Mucosal Immunology, https://doi.org/10.1038/mi.2009.134
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。






 个人中心
个人中心
 我是园区
我是园区




