蛋白质翻译后修饰
(PTM)
在控制植物生长发育以及逆境适应方面发挥着重要的作用。发生在半胱氨酸巯基的亚磺酰化修饰
(R-SOH)
是一种可逆的氧化修饰类型,可以通过与其他修饰形态形成二硫键的形式来保护蛋白不被氧化损伤,是调控蛋白功能、代谢通路以及激素信号的重要方式。蛋白的氧化还原修饰被认为是ROS信号在细胞内和细胞间传递的重要途径。
2021年8月4日,华中农业大学油菜团队
郭亮
课题组在国际知名期刊
Plant, Cell & Environment
(IF=7.228)
上发表了题为 “
Proteome-wide identification of S-sulfenylated cysteines in Brassica napus
” 的研究论文,
运用氧化还原修饰组学技术,详细阐述了盐胁迫下油菜叶片内源亚磺酰化修饰蛋白的分布及变化特征。
景杰生物
为该研究的氧化还原修饰组学定量提供了技术支持。
半胱氨酸巯基的亚磺酰化修饰是极其不稳定状态,容易被还原或者进一步氧化,因此亚磺酰化修饰位点的鉴定方法选择尤为关键。该研究结合了iodoTMT标记和串联质谱相结合的方法
(质谱策略)
,对油菜叶片在对照及盐处理条件下
(样本策略)
的亚磺酰化修饰位点进行定性和定量。iodoTMT标签仅与巯基基团
(还原的未经修饰半胱氨酸残基)
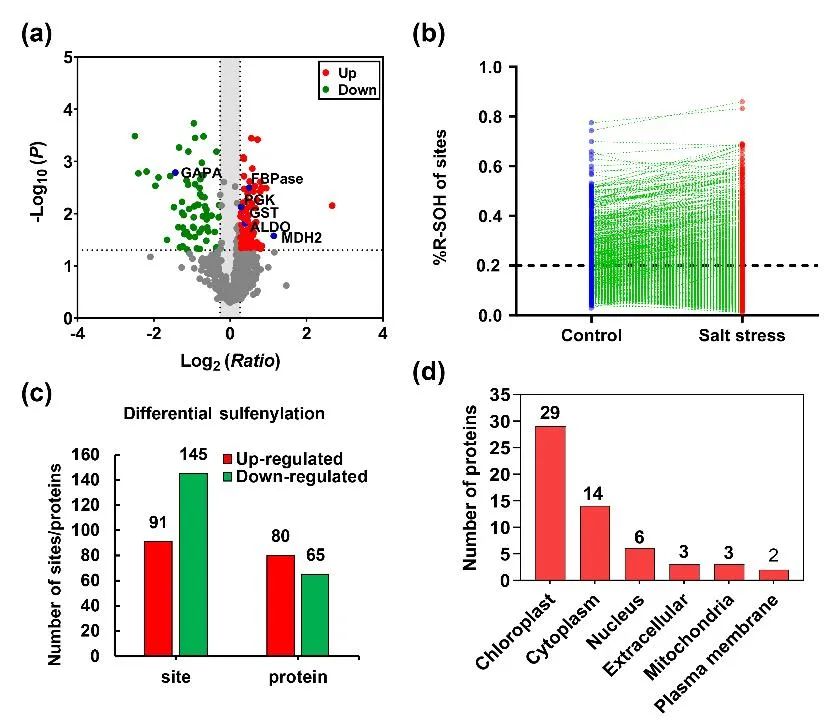
发生反应,结合强还原剂TCEP和R-SOH特异性的还原剂亚砷酸盐,实现对总半胱氨酸和亚磺酰化修饰半胱氨酸的分别标记和定量。另外在蛋白提取的同时对还原态的巯基进行可逆的封闭,最大限度地保持了样本中原始的巯基状态和水平。采用这种策略,研究总共鉴定到位于912个蛋白上的1821个修饰位点。
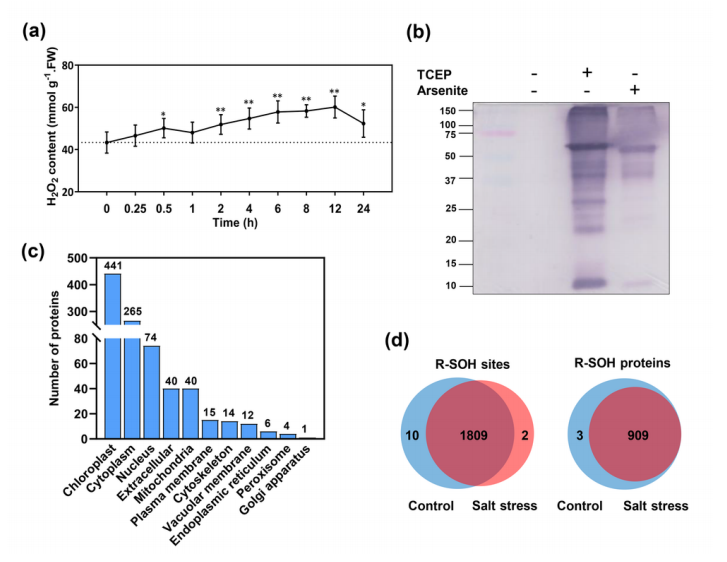
进一步生信分析发现,亚磺酰化修饰蛋白大多分布在叶绿体和细胞质中。功能富集分析揭示,在光合作用以及糖酵解等代谢途径有大量的酶发生被修饰。在盐胁迫条件下,细胞内的总体氧化修饰水平表现出明显的上升趋势,并有大量蛋白从低修饰水平
(%R-SOH<20%)
转变为高修饰水平
(%R-SOH>20%)
。重组蛋白PGK
(磷酸甘油酸激酶)
及FBPase
(果糖-1,6-二磷酸酶)
的体外修饰验证及酶活性分析也证实了酶的氧化修饰显著影响酶的活性。
该研究利用氧化还原修饰组学方法,研究了甘蓝型油菜在短期盐胁迫反应过程中可逆的半胱氨酸修饰。研究在盐胁迫下鉴定到912个氧化还原修饰蛋白的亚磺酰化修饰水平的变化,并观察到盐胁迫期间体内氧化水平的增加。这些亚磺酰化蛋白质含有大量代谢酶,并参与各种生物过程,如光合作用和葡萄糖代谢。研究结果增加了我们对逆境胁迫下蛋白氧化还原修饰景观的认识,并为氧化还原修饰蛋白功能研究及氧化还原调控网络的理解提供了思路和基础。
本文由景杰学术团队报道,欢迎转发到朋友圈。如有转载、投稿等其他合作需求,请文章下方留言,或添加微信ptm-market咨询。
#关注领取新人福利,下载最近三年影响因子(后台发送关键词“新人”)



 药选址
药选址


