▎药明康德内容团队编辑
日前,安进(Amgen)和阿斯利康(AstraZeneca)联合宣布,“first-in-class”抗体疗法Tezspire(tezepelumab-ekko)获得美国FDA批准,作为附加维持疗法,治疗12岁以上儿童和成人严重哮喘患者。

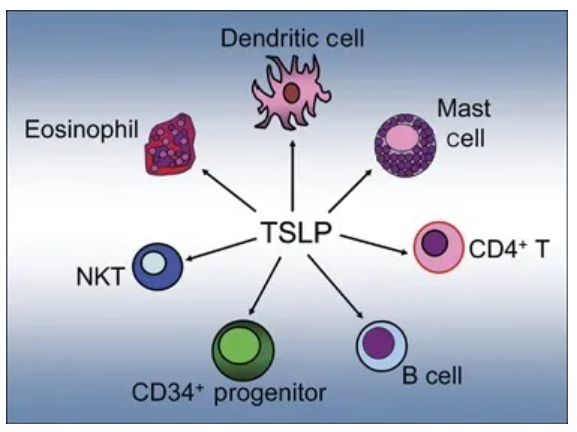
Tezspire是一款靶向抗胸腺基质淋巴细胞生成素(TSLP)的单克隆抗体疗法。TSLP是一种上皮细胞因子,位于多个炎症级联反应的顶端,启动过敏性、嗜酸性粒细胞和其他类型与严重哮喘相关的气道炎症的过度免疫反应。美国FDA于2018年9月授予tezepelumab突破性疗法认定,用于治疗无嗜酸性粒细胞表型的重度哮喘患者。它的生物制品上市申请也获得FDA的优先审评资格。
▲TSLP对多种免疫细胞的免疫反应产生影响(图片来源:参考资料[2])
这一批准是基于名为PATHFINDER的临床开发项目,包括关键性3期临床试验NAVIGATOR的结果。NAVIGATOR试验结果于2021年5月发表在《新英格兰医学杂志》上。试验结果显示,在治疗症状未受控制的重度哮喘患者时,tezepelumab达到试验所有主要终点和关键性次要终点。与安慰剂相比,将每年哮喘急性加重率(AAER)降低56%(p<0.001)。
新闻稿指出,tezepelumab是首个在多个2期和3期临床试验中,针对广泛具有不同特征的严重哮喘患者,一致和显著减少哮喘急性加重的生物制品。
NAVIGATOR试验的主要研究者,皇家布朗普顿医院的Andrew Menzies-Gow教授表示,由于严重哮喘的复杂和异质性特征,虽然新药开发获得进展,很多患者仍然出现频繁疾病急性加重,严重降低生活质量并提高住院风险。Tezspire对无法控制症状的严重患者来说提供了一款急需的新治疗选择。
参考资料:
[1] TEZSPIRE (tezepelumab) Approved in the US for Severe Asthma. Retrieved December 18, 2021, from https://www.businesswire.com/news/home/20211217005407/en
[2] Comeau & Ziegler. (2009). The influence of TSLP on the allergic response. Mucosal Immunology, https://doi.org/10.1038/mi.2009.134
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。







 个人中心
个人中心
 我是园区
我是园区




