「 本文共:16条资讯,阅读时长约:3分钟 」




1.罗氏“不限癌种”新药在华获批上市。罗氏NTRK/ROS1酪氨酸激酶抑制剂恩曲替尼(entrectinib)胶囊获国家药监局批准上市,用于治疗NTRK融合阳性局部晚期或转移性实体瘤。在多项临床中,entrectinib治疗在NTRK融合阳性实体瘤患者中达到57.4%的客观缓解率(ORR),中位缓解持续时间(DOR)达到10.4个月。FDA已于2019年8月加速批准其上市,用于治疗携带NTRK基因融合的晚期复发性实体瘤患者。
2.礼来IL-17A抑制剂在华获批新适应症。礼来IL-17A抑制剂依奇珠单抗注射液的新适应症获国家药监局批准。IL-17A是一种天然存在的细胞因子,参与正常的炎症和免疫反应。该新药此前已在中国获批用于治疗中重度斑块型银屑病。在一项Ⅲ期临床(RHCH)中,依奇珠单抗用于中国活动性放射学阳性中轴型脊柱关节炎(r-axSpA)患者达到主要终点和所有关键次要终点,与安慰剂相比,该新药用于bDMARD初治的活动性r-axSpA患者达到ASAS40的患者比例显著更高。
3.石药多西他赛纳米粒获孤儿药资格。石药集团中奇制药开发的2类化药注射用多西他赛(白蛋白结合型)获FDA授予孤儿药资格,用于治疗胃癌(包括食道胃结合部癌)。该新药采用创新的人血白蛋白包裹技术,将多西他赛纳米粒输送至患者体内。临床数据显示,该新药在胃癌患者二线治疗的客观缓解率(ORR)达40%,是普通注射液的2倍。
4.金赛药业SARM获批干眼症临床。金赛药业1类新药EG017软膏获国家药监局临床试验默示许可,拟开发用于治疗绝经后女性干眼症。EG017是金赛药业从宁波熙健医药受让的一款选择性雄激素受体调节剂(SARM)。此前,由宁波熙健医药申报的EG017片已在国内获批临床,拟定适应症包括不考虑生育的中老年女性的干眼症、不考虑生育的中老年女性的压力性尿失禁。
5.宝船CLDN18.2/CD47双抗获FDA临床许可。FDA批准宝船生物CLDN 18.2/CD47双特异性抗体注射液BC007的临床试验申请(IND),拟用于治疗晚期实体瘤。宝船生物即将在美国开展I 期临床试验,评估BC007的安全性、耐受性、药代动力学特征、免疫原性和初步抗肿瘤疗效。2022年6月,该新药在国内的临床试验申请也获得CDE受理,是首款在国内申报临床试验的CLDN18.2/CD47双抗。


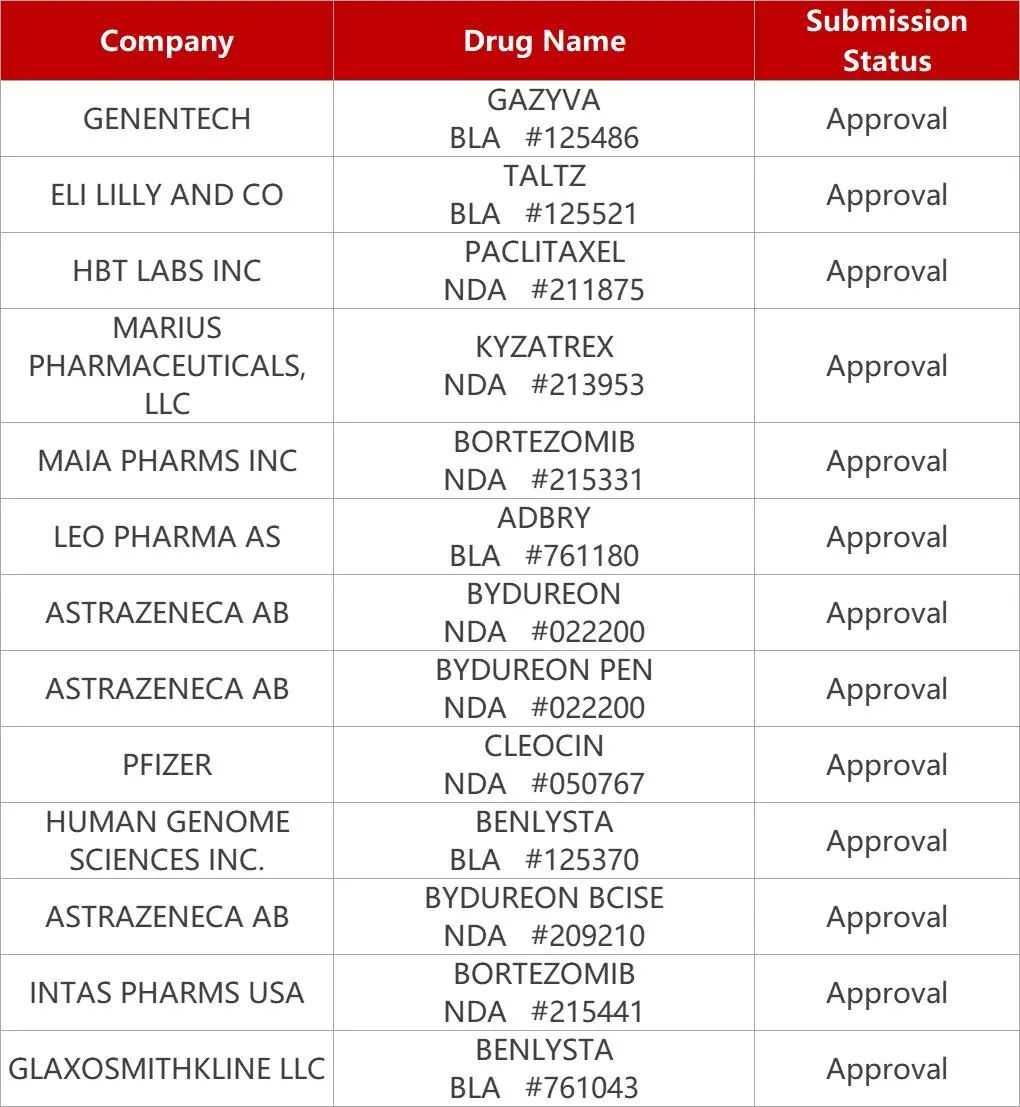
1.贝利尤单抗获FDA批准用于儿童狼疮肾炎。葛兰素史克BLyS靶向单抗贝利尤单抗(Benlysta)获FDA扩展适应症,该新药此前已获FDA批准用于治疗狼疮性肾炎(LN)成人患者,此次FDA批准将治疗人群扩展至正在接受标准治疗的5岁至17岁LN患者。Benlysta也是全球首款且唯一一款治疗儿童LN的生物制剂。LN是一种由系统性红斑狼疮(SLE)引起的肾脏炎症,并可能导致终末期肾病。目前Benlysta已获FDA批准同时用于SLE和LN。
2.SGLT1/2双重抑制剂心衰适应症报NDA。Lexicon公司宣布已向FDA提交SGLT1/2双重抑制剂sotagliflozin的新药申请(NDA),用于治疗心力衰竭。FDA预计明年5月前做出答复。Lexicon公司在ACC.2021会议上公布sotagliflozin用于治疗患有2型糖尿病和心力衰竭(HF)的患者,以及治疗患有2型糖尿病和慢性肾脏病且存在心血管疾病危险因素的患者的两项研究(SOLOIST和SCORED)的积极结果。汇总结果显示,支持sotagliflozin对全部HF患者的益处,包括射血分数保留性心力衰竭(HFpEF)以及具有中等范围射血分数的HF患者。
3.罗氏引进DMD基因疗法将报BLA。Sarepta公司与罗氏联合开发的基因转移疗法SRP-9001(delandistrogene moxeparvovec)计划今年第三季度向FDA提交生物制品许可申请(BLA),用于治疗杜氏肌营养不良症(DMD)。两家公司计划向FDA申请加速批准SRP-9001上市。SRP-9001旨在将编码微营养不良蛋白的基因传递到肌肉组织,以产生目标蛋白——微营养不良蛋白,是一种针对全部DMD患者的潜在治愈性疗法。
4.IL-15激动剂在美报NDA。ImmunityBio公司IL-15超级激动剂N-803的上市申请获FDA受理,用于治疗卡介苗不响应的非肌层浸润性膀胱癌(NMIBC),PDUFA日期为2023年5月23日。在一项II/III期临床(QUILT 3.032)中,卡介苗联合N-803治疗在原位癌+/-乳头状肿瘤的NMIBC患者中达到71%的完全缓解率,反应的中位时间超过两年;只有16%的患者进行膀胱切除术。药物的毒副作用结果显示,几乎没有出现全身性的副作用。
5.拜耳抗血栓反义寡核苷酸疗法Ⅱb期临床积极。拜耳与Ionis公司开发的FXI靶向反义寡核苷酸疗法fesomersen,用于肾病患者预防血栓的Ⅱb期临床达到主要终点。在接受透析的终末期肾病患者中,fesomersen与安慰剂相比,显著降低患者的凝血因子XI(FXI)活性水平,而且没有增加患者严重出血事件和具有临床意义的非严重出血事件。药物的总体耐受性良好。详细数据将在医学会议上公布。
6.O+Y辅助治疗局限性肾癌III期临床失败。百时美施贵宝PD1纳武利尤单抗 (Opdivo)联合CTLA4抑制剂伊匹木单抗(Yervoy)辅助治疗局限性肾细胞癌(RCC)的III期临床(CheckMate -914 part A)未达到主要研究终点。与安慰剂相比,Opdivo+Yervoy未能改善手术切除并具有高复发风险的RCC患者的无病生存期(DFS)。目前,这一组合已在一线治疗中低风险RCC患者(CheckMate -214)、一线治疗晚期RCC患者(CheckMate -9ER和COSMIC-313)以及二线治疗晚期或转移性RCC患者(CheckMate -025)的临床中取得积极结果。
7.辉瑞上半年营收534亿美元。辉瑞公布2022年上半年业绩报告,上半年营收534亿美元,同比增长60%;净利润为177.69亿美元,同比增长70%;研发投入51.16亿美元,同比增长21%。2022年第二季度营收277.42亿美元,同比增长53%;新冠口服药Paxlovid和新冠疫苗Comirnaty销售额分别为81亿美元和88亿美元;销售前7大产品创收224.39亿美元,占总收入81%,分别为Comirnaty、Paxlovid、Eliquis、PrevnarFamily、lbrance、Vyndaqel/Vyndamax、Xeljanz。


1.我国进一步推动核酸检测结果全国互认。7月29日,国务院应对新冠肺炎疫情联防联控机制综合组发布通知,要求进一步推动核酸检测结果全国互认。通知明确,群众通过国务院客户端、国家政务服务平台、各省份健康码、核酸检测机构网站或APP查询到的核酸检测结果及群众持有的纸质核酸检测结果,凡在当地防控政策有效时间内的,具有同等效力,各地在查验时都应当予以认可,严禁以本地健康码未能查询、未在本地开展核酸检测等为由拒绝通行,拒绝群众进入公共场所、乘坐公共交通工具,不得要求群众重复进行核酸检测。
2.四家国家级精神疾病医学中心出炉。7月29日,国家卫健委发布关于设置国家精神疾病医学中心的通知,将北京大学第六医院、中南大学湘雅二医院、首都医科大学附属北京安定医院、上海市精神卫生中心作为国家精神疾病医学中心主体医院,负责医学中心日常运行和管理;并要求各省市要切实履行地方主体责任,加大经费投入,给予政策支持,完善配套措施,推进医学中心建设和发展可持续。
3.经常午睡可能增加高血压及中风风险。近日,中南大学湘教授团队在 Hypertension 期刊最新发表的“Association of nap frequency with hypertension or ischemic stroke supported by prospective cohort data and Mendelian randomization in predominantly middle-aged European subjects ”研究论文。该研究表明,经常午睡,可能是高血压和中风发生的危险因素。与从不午睡的人相比,经常午睡的人患高血压的风险高12%,中风的风险高24%。




上个交易日 A 股医药板块 -2.18%
涨幅前三 跌幅前三
*ST 科华 +5.01% 奥翔药业 -10.00%
*ST 必康 +4.98% C 英诺特 -9.46%
万 邦 德 +4.46% 昊海生科 -6.97%
【信立泰]公司的SAL0114片已按I期临床方案完成首例受试者的入组。
【桂林三金】控股孙公司宝船生物的BC007抗体注射液用于晚期实体瘤治疗获得美国FDA药品临床试验批准。
【迈威生物】9MW2821的新药临床试验申请获得FDA批准通知书。
【恒瑞医药】注射用HRS-8427获得药物临床试验批准通知书。
- The End -





 个人中心
个人中心
 我是园区
我是园区




